УДК 579.26
Особенности РОСТА
монокультур Микроорганизмов
на неровных
поверхностях
©2012 г. К. А. Корляков, Нохрин Н. Ю.
Арсентьева Н.Ю.
Государственное бюджетное
образовательное учреждение высшего профессионального образования “Челябинский
государственный университет”, г. Челябинск, Россия
В последние двадцать лет продолжает расти число
работ по структурно-функциональным характеристикам колоний микроорганизмов
(пленок, флоков и др.). Вместе с тем в гидробиологии и экологии наземных
биоценозов накапливаются данные, в том числе и экспериментальные, о влиянии
сложных трехмерных субстратов на структурно-функциональные свойства населяющих
их биоценозов. В частности известно, что сложные трехмерные субстраты в отличие
от двухмерных поверхностей создают интенсивные флуктуации физико-химических и
физических параметров среды, что способствует образованию экосистем с высокой
динамичностью - экотонов [1; 2; 3; 4; 5;
6]. Изучение влияния неровности рельефа твердых поверхностей на отдельные
популяции и сообщества в микробиологии и гидробиологии единичны [7; 8; 9]. Учитывая
характер экспериментального изучения биопленок-колоний в двухмерных условиях
среды большой интерес может представлять изучение экологических особенностей
биопленок развивающихся на трехмерных субстратах и связанные с этим перспективы
экологического моделирования биопродукционных процессов. Цель нашей работы
состояла в изучении влияния неровности рельефа стекол на формирование отдельных
культур микроорганизмов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами были использованы четыре культуры
микроорганизмов различных по экологической специфике: Pseudomonas
aeruginosa, Staphylococcus aureus, Escherichia coli и Enterococcus faecalis.
Предметные стекла были разделены на 5 секторов, на которых абразивной шкуркой
были нанесены углубления различной толщины: 7.8 мкм, 23.4 мкм, 78 мкм и 235
мкм. Расстояния между углублениями составили соответственно: 78 мкм, 195 мкм,
312 мкм и 585 мкм. Сектора были расположены в порядке возрастания толщины
углублений и увеличения удельных поверхностей (рис. 1). Пятый сектор оставался
необработанным (ровным) и использовался в качестве контроля. Зная форму, ширину
углублений и расстояний между ними нами были рассчитаны площади поверхности 4
секторов стекла с учетом рельефа (табл. 1) Стекла
перед применением проходили дезинфекционную обработку (выдерживание в 96 %
спирте) и стерилизацию (фломбирование). В качестве жидкой фазы для выращивания
микроорганизмов использовали мясопептонный бульон. Культивирование осуществляли
при температуре 37оС в одноразовых чашках Петри, содержащих по 20 мл
среды. Первые результаты в трехкратной повторности снимали через 1, 2, 3, 4, 5,
10, 24 часа.
В ходе статистического анализа использовали
методы описательной статистики и выборочных сравнений. Расчёты средних значений
и 95%-ных доверительных интервалов (95% ДИ) численности микроорганизмов проводились
после предварительного логарифмического преобразования вида: у=lg(x+0.5) с
последующей ретрансформацией к исходной шкале [10, 12]. Оценку статистической
значимости эффектов проводили в ходе двухфакторного (факторы: “Рельеф”, “Время”)
и трёхфакторного (факторы: “Сектор”, “Рельеф”, “Время”) дисперсионного анализов.
При этом также использовались лог-преобразованные данные, а апостериорные
сравнения в рамках дисперсионных комплексов проводились с помощью критерия
Тьюки (Tukey’s HSD) [13]. Во всех случаях эффекты и различия считали
статистически значимыми при Р£0.05, незначимыми – при P>0.10, промежуточные
значения (0.05£Р£0.10) обсуждали в качестве тенденций. Расчёты и
графические построения выполнены в пакетах Statistica (v. 8.0, StatSoft Inc.) и
KyPlot [14].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность
клеток на ровной и неровной поверхностях. Все четыре культуры микроорганизмов отличались более высокой
численностью в первые 2-4 часа на ровной поверхности – в контроле (табл. 2).
Начиная со 2-4 часа численность клеток на неровной поверхности начинала
превалировать над численностью в контроле. Причем у S. aureus на 2-4 часах и у E. coli на 10-м часу
численность на неровном рельефе превышала таковую на ровной поверхности на один
порядок. Аналогичная картина наблюдалась у E. faecalis в 1 секторе на 5 часу
экспозиции. На последней фиксированной точке времени (10 ч.) численность была
выше у всех организмов на 1 и 4 секторах, кроме E. faecalis (табл. 2).
Через сутки (24 ч.) на всех четырех секторах, включая контроль образовывалась
биопленка.
Средняя численность по всем четырем
секторам, то есть на неровном рельефе по сравнению с ровным характеризовалась
следующими особенностями (табл. 2, последняя колонка). У E. faecalis численность
клеток на неровном рельефе уже на первом часу превышала численность на
контрольном участке (табл.). При этом от часа к часу максимальная численность
отмечалась на различных секторах. У E. coli и S. aureus численность
клеток на неровном рельефе начинала опережать численность на ровной поверхности
на 3 и 2 часах соответственно. Численность P. aeruginosa на неровной поверхности
начинала превалировать над численностью в контроле лишь на 5 часу.
Численность
клеток в углублениях и между углублениями. Характер распределения микроорганизмов на качественно различных
участках, то есть в углублениях, участках между углублениями рельефа стекла и
контроле характеризовался следующими особенностями. У 3 культур из 4
(исключение – E. faecalis) наиболее интенсивно рост начинался на ровной поверхности
стекла (контрольный сектор № 5). На 3-4 часах инкубации интенсивность роста в
углублениях сравнивалась с контролем или опережала его (рис. 2). В дальнейшем
эта тенденция усиливалась и на 5-10 часах численность микроорганизмов в углублениях существенно превосходила их
численность на ровных участках поверхности. В целом, для всех 4 микроорганизмов
в ходе апостериорных сравнений было обнаружено высоко статистически значимое
превосходство численности в углублениях по сравнению с ровными участками между
углублений (P<0.001), а для P. aeruginosa, S. aureus и, возможно, E.
faecalis – также по сравнению с контрольным сектором (Р равно соответственно
0.017, 0.027 и 0.064). С учетом различной площади поверхности стекла на 4
секторах нами были получены значения плотности клеток с учетом кривизны
поверхности (табл. 3). Плотность клеток на неровной поверхности у S.
aureus, E. faecalis на 2 часу экспозиции и у E. coli на 3 часу
экспозиции начинала превышать численность клеток в контроле. Плотность клеток
на неровном рельефе у P. aeruginosa начинала превалировать над
плотностью в контроле на 4-5 часах экспозиции.
Численность
клеток в различных по размеру углублениях. Особенности роста численности клеток в различных по размеру углублениях
на 4-х секторах характеризовались следующими особенностями. Численность клеток
у P. aeruginosa в углублениях на 1 и 4 секторах превышала численность
на 2 и 3 секторах на протяжении всей временной экспозиции (рис. 3). Такое согласованное распределения бактерий по секторам
во времени было статистически значимым: коэффициент конкордации Кендалла W=0,767; Р=0,003. У S. aureus численность
была выше на 4 секторе по сравнению другими секторами на протяжении почти всей
экспозиции за исключением 10 часа. Эффект сектора для S. aureus не выявился, но
имел показатели близкие показатели к статистически значимой тенденции:
коэффициент конкордации Кендалла W=0,411; Р=0,060. Тогда как у E. coli (W=0,300; Р=0,145)
и E. faecalis (W=0,144; Р=0,586)
наблюдалась противоположная тенденция – рост клеток был более нестабильным и
максимальная численность наблюдалась на различных секторах в различные
промежутки времени. Если в качестве интегральной характеристики комфортности условий
инкубации рассматривать усреднённое по всем секторам число клеток в поле зрения
углублений на последнем временном отрезке (10 ч), то бактерии расположатся в
следующем убывающем порядке: P. aeruginosa (![]() =983,8 клеток), S. aureus (894,5), E. сoli (869,1),
E. faecalis (366,0). Эта последовательность соответствует
убыванию коэффициента конкордации, что указывает на простое объяснение
согласованного характера роста культур в секторах: чем комфортнее условия
инкубации и выше численность клеток, тем стабильнее проявляются закономерности
распределения бактерий по секторам.
=983,8 клеток), S. aureus (894,5), E. сoli (869,1),
E. faecalis (366,0). Эта последовательность соответствует
убыванию коэффициента конкордации, что указывает на простое объяснение
согласованного характера роста культур в секторах: чем комфортнее условия
инкубации и выше численность клеток, тем стабильнее проявляются закономерности
распределения бактерий по секторам.
Эффект сектора наблюдаемый на изученном
временном отрезке хорошо прослеживается по ранжированию интенсивности роста
микроорганизмов (рис. 3). Как видно из рисунка для P. aeruginosa и
S. aureus хорошо прослеживается наибольшая численность в
отмеченных выше секторах, тогда как для E. faecalis наблюдается переход пиков (скачков) роста от одного сектора к другому в
виде «волны». Следует отметить, что 4 сектор интенсивно освоенный S. aureus и P. aeruginosa
отличался самыми маленькими размерами углублений и самой маленькой удельной
поверхностью (табл. 1). В свою очередь 1 сектор интенсивно заселенный P. aeruginosa наоборот
отличался наибольшими по размеру углублениями и наибольшей удельной
поверхностью.
Средняя плотность клеток с учетом неровной
поверхности (рельефа поверхности, ее кривизны) и высокие численности у
интенсивно развивающихся видов (P. aeruginosa и
S. aureus) на секторе с низкой удельной поверхностью (4 сектор)
свидетельствуют о том, что высокая численность на неровном рельефе не может
объясняться относительно большими площадями неровных секторов. То есть
увеличение численности микроорганизмов не имеет прямой зависимости с
увеличением удельной поверхности стекла, а вероятно связана с иными
экологическими особенностями: аккумуляцией питательных веществ в углублениях и
особенностями прикрепления микроорганизмов. E. faecalis отличающийся как отмечено выше самым медленным ростом, уже на
первом часу активно осваивал неровную поверхность, а в дальнейшем интенсивно
мигрировал (наблюдались пики максимальной численности на различных часах) по секторам
с различными углублениями (табл. 2, рис. 3). P. aeruginosa
наоборот характеризующаяся самым интенсивным ростом и для которой выявился
статистически значимый сектор отличалась более высокой численностью на неровном
рельефе по сравнению с контролем лишь на 5 часу экспозиции (табл. 2). S. aureus и E. сoli
занимающие промежуточное положение по
интенсивности роста начинали осваивать неровную поверхность на 2 и 3 часах.
Таким образом, численность клеток у всех
монокультур микроорганизмов увеличивалось быстрее на неровном рельефе в
сравнении с контролем. На неоднородных участках поверхности клетки быстрее
росли в углублениях и, по всей видимости, мигрировали в них с участков между
углублениями. Активное освоение углублений всеми изученными бактериями вероятно
объясняется неравномерностью распределения питательных веществ в виде
«сгустков», что обуславливает «краевой эффект» в формировании первичных
поселений. Набор микроорганизмов и набор различных углублений выявил
определенные видовые предпочтения к освоению различных по размеру углублений.
Два вида проявили предпочтения к
определенным секторам, а другие два ни к одному из секторов. Однако говорить о
специализации на некоторых фазах роста колоний отдельных видов бактерий к
освоению определенного размера углублений или «ячеек» рано, это требует
дополнительных исследований с набором различных форм углублений и изучение
специфики прикрепления микроорганизмов. Показательным был E. faecalis, который при самом нестабильном росте сразу начал
осваивать неровную поверхность при этом еще мигрировал с одного сектора на
другой. То есть в противовес возможной специализации двух других видов к
определенным по размеру ячейкам секторов, «волновой» тип миграции по различным
секторам при высоких энергозатратах может свидетельствовать о универсальности
или некоторой пластичности видов в отношении освоения различных биотопов. Возможно,
на скачках численности в наборе различных углублений идет выработка и отбор
приспособлений к поиску оптимального биотопа. То есть при подборе оптимальной
среды для E. faecalis и E. сoli эффект
сектора также может выявится. Таким образом, можно предположить, что каждая
культура стремится к специализации в части освоения «ячеек» определенного
сектора, при этом может сохранятся универсальность по отношению абиотическим и
трофическим факторам среды.
СПИСОК ЛИТЕРАТУРЫ
Харченко Т.А. Концепция экотонов в гидробиологии //
Гидробиологический журнал. 1991. Т. 27. № 4. С. 3–10.
Протасов А.А. Пресноводный перифитон. Киев: Наук. думка, 1994. 307 с.
Залетаев В.С. Структурная организация экотонов в
контексте управления // Экотоны в биосфере. М.: РАСХН, 1997. С. 5–30.
Олейник Г.Н. Бактериопланктон и бактериобентос в
экотонных экосистемах // Гидробиологический журнал. 1997. Т. 33. № 1. С. 51–62.
Шарипова М.Ю. Альгоценозы экотонов: экология,
флористический состав, структура: на примере Южно-Уральского региона.
Автореферат дис. … д-ра биол. наук. Уфа. 2006. 38 с.
Соловьева В.В., Розенберг Г.С. Современное
представление об экотонах или теория экотонов // Успехи современной биологии. 2006. Т. 126. № 6. С. 531–549.
Зевина Г.В. Обрастания в морях СССР. М.: изд-во Моск.
ун-та, 1972. 214 с.
Горленко В.М. Экология водных микроорганизмов. М.: Наука, 1977. 288 с.
Shapiro J.A., Trubatch D. Sequential events in
bacterial colony morphogenesis // Physica D. 1991. V.49. N 1-2. P. 214–223.
Yamamura K. Transformation using (x+0.5)
to stabilize the variance of population // Res. Popul. Ecol.. 1999. V. 41. P.
229–234.
Jarvis B. Statistical Aspects of the
Microbiological Examination of Foods. Elsevier
Academic Press, 2008. 306 p.
Монтгомери Д.К. Планирование
эксперимента и анализ данных. Пер. с англ. Л.: Судостроение, 1980. 384 с.
Yoshioka K. KyPlot – a user-oriented tool
for statistical data analysis and visualization // Computational Statistics. 2002. V. 17, № 3. P. 425–437.
Таблица 1. Площадь
поверхности стекла на разных секторах
|
№ сектора |
Площадь «углублений», мм2 |
Площадь участков между «углублениями», мм2 |
Общая площадь сектора, мм2 |
|
1 |
181,45 |
289,0 |
470,3 |
|
2 |
127,2 |
324,5 |
451,7 |
|
3 |
67,2 |
354,9 |
422,1 |
|
4 |
56,6 |
359,0 |
415,6 |
|
Контроль |
|
|
395,2 |
Таблица 2. Численность клеток (клеток в поле зрения) 4 культур микроорганизмов на стеклах разделенных на сектора с различными по размеру углублениями.
|
Часы |
Контроль |
Количество клеток на
неровной поверхности |
||||
|
1 сектор |
2 сектор |
3 сектор |
4 сектор |
Среднее по 4 секторам |
||
|
|
E. coli |
|||||
|
1 |
8 |
4 |
10 |
4 |
1 |
5 |
|
2 |
9 |
7 |
10 |
6 |
1 |
6 |
|
3 |
154 |
250 |
313 |
382 |
234 |
295 |
|
4 |
262 |
393 |
456 |
382 |
400 |
408 |
|
5 |
321 |
555 |
621 |
495 |
559 |
557 |
|
10 |
2735 |
13022 |
11018 |
10244 |
12635 |
11730 |
|
|
S. aurus |
|||||
|
1 |
25 |
12 |
20 |
19 |
21 |
18 |
|
2 |
42 |
117 |
149 |
135 |
161 |
140 |
|
3 |
46 |
424 |
390 |
427 |
435 |
419 |
|
4 |
789 |
1583 |
1581 |
1697 |
2048 |
1727 |
|
5 |
2553 |
6762 |
6834 |
6832 |
7636 |
7016 |
|
10 |
6411 |
13351 |
12643 |
13182 |
13328 |
13126 |
|
|
E. fecalis |
|||||
|
1 |
34 |
10 |
20 |
104 |
40 |
43 |
|
2 |
83 |
102 |
114 |
107 |
57 |
95 |
|
3 |
105 |
151 |
129 |
119 |
183 |
145 |
|
4 |
131 |
203 |
187 |
313 |
276 |
245 |
|
5 |
300 |
1432 |
615 |
470 |
546 |
765 |
|
10 |
2183 |
3740 |
3884 |
8271 |
8203 |
6024 |
|
|
P. aurogenosa |
|||||
|
1 |
11 |
8 |
2 |
3 |
2 |
4 |
|
2 |
11 |
7 |
3 |
3 |
6 |
5 |
|
3 |
11 |
12 |
6 |
7 |
11 |
9 |
|
4 |
33 |
59 |
15 |
14 |
28 |
29 |
|
5 |
128 |
383 |
284 |
324 |
460 |
363 |
|
10 |
16165 |
48426 |
20818 |
35643 |
42501 |
36847 |
В последней колонке жирным шрифтом выделены значения численности на тех часах, на которых численность на неровной поверхности стекла начинает превышать численность в контроле.
Таблица 3. Плотность клеток
(тыс. кл/мм2) на различных секторах стекла с учетом геометрии рельефа.
|
Часы |
Контроль |
1 сектор |
2 сектор |
3 сектор |
4 сектор |
|
|
E. coli |
||||
|
1 |
0.32 |
0.13 |
0.35 |
0.15 |
0.03 |
|
2 |
0.36 |
0.23 |
0.35 |
0.22 |
0.03 |
|
3 |
6.16 |
8.40 |
10.95 |
14.30 |
8.90 |
|
4 |
10.48 |
13.21 |
15.95 |
14.30 |
15.21 |
|
5 |
12.84 |
18.65 |
21.73 |
18.53 |
21.26 |
|
10 |
109.40 |
437.70 |
385.20 |
383.64 |
480.59 |
|
|
S. aurus |
||||
|
1 |
1.00 |
0.40 |
0.70 |
0.71 |
0.79 |
|
2 |
1.68 |
3.93 |
5.21 |
5.05 |
6.12 |
|
3 |
1.84 |
14.25 |
13.64 |
15.99 |
16.54 |
|
4 |
31.56 |
53.20 |
55.33 |
63.55 |
77.89 |
|
5 |
102.12 |
227.28 |
239.16 |
255.86 |
290.44 |
|
10 |
256.44 |
448.76 |
442.46 |
493.67 |
506.95 |
|
|
E. fecalis |
||||
|
1 |
1.36 |
0.33 |
0.70 |
3.89 |
1.52 |
|
2 |
3.32 |
3.42 |
3.99 |
4.00 |
2.16 |
|
3 |
4.20 |
5.07 |
4.51 |
4.45 |
6.96 |
|
4 |
5.24 |
6.82 |
6.54 |
11.72 |
10.49 |
|
5 |
12.00 |
48.13 |
21.52 |
17.60 |
20.76 |
|
10 |
87.32 |
125.71 |
135.92 |
309.75 |
312.01 |
|
|
P. aurogenosa |
||||
|
1 |
0.44 |
0.26 |
0.07 |
0.11 |
0.07 |
|
2 |
0.44 |
0.23 |
0.10 |
0.11 |
0.22 |
|
3 |
0.44 |
0.40 |
0.21 |
0.26 |
0.41 |
|
4 |
1.32 |
1.98 |
0.52 |
0.52 |
1.06 |
|
5 |
5.12 |
12.87 |
0.994 |
12.134 |
17.49 |
|
10 |
646.60 |
1627.72 |
728.56 |
1334.86 |
1616.59 |
Примечания. Жирным шрифтом выделены максимальные значения плотности.
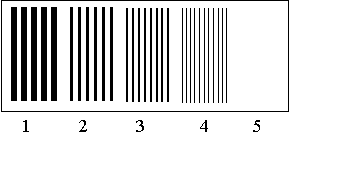
Рис. 1. Схема стекла с секторами:
1 сектор – ширина углублений 235 мкм, 2 сектор – ширина углублений 78 мкм, 3
сектор – ширина углублений 23.4 мкм, 4 сектор – ширина углублений 7.8 мкм, 5
сектор – контроль.

Рис.2. Динамика роста
микроорганизмов: средние значения по 4 секторам, 95% ДИ. Микроорганизмы: а) P. aeruginosa; б) E. сoli; в) S. аureus; г)
E. faecalis. Условия эксперимента: 1
– в углублениях, 2 – между углублениями, 3 – контроль.
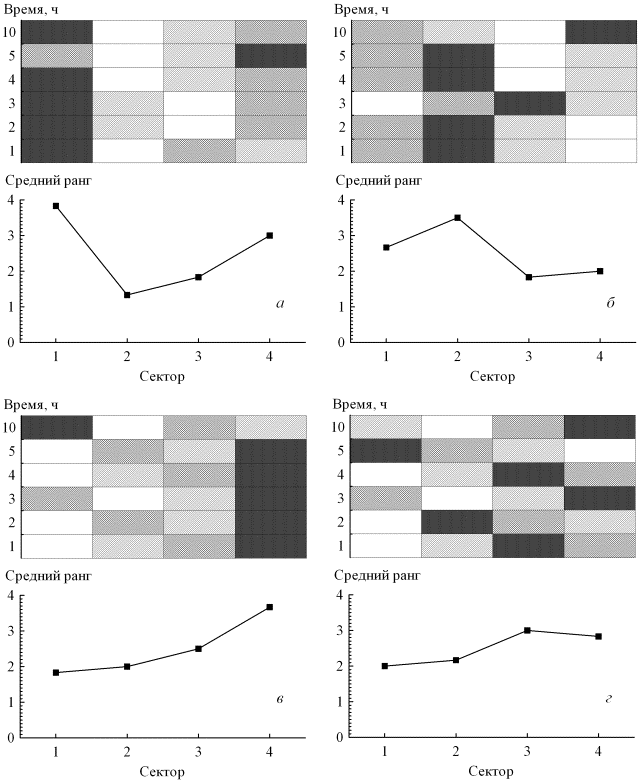
Рис. 3. Эффект сектора.
Ранжирование интенсивности роста микроорганизмов (белый цвет – минимальный
рост, чёрный цвет – максимальный рост) и средние ранги. а) P. aeruginosa; б) E. сoli;
в) S. аureus; г) E. faecalis.