Студент Разиньков Д.Ю.,
студент Будыкина Д.В., к.х.н Борщ Н.А.
Юго-Западный государственный университет,
Россия
Практическое применение спектрофотометрии для
определения бензойной кислоты и тиомочевины при их совместном присутствии.
В современных лабораториях широко
используются различные спектральные приборы, такие как фотометр,
фотоколориметр, спектрометр и спектрофотометр. Применение данного класса
приборов в химическом анализе основано на законе Бугера-Ламберта-Бера для
растворов поглощающих веществ в непоглощающих растворителях, позволяющем
определять концентрации растворенных веществ. Эти приборы доказали свою эффективность в самых трудоемких
научно-исследовательских проектах. И сегодня их используют практически во всех
работах, связанных с растворами.
Целью данной работы являлось
спектрофотометрическое определение бензойной кислоты и тиомочевины в водных
растворах при их совместном присутствии. Работу проводили на спектрофотометре «UV-1800»
фирмы «Shimadzu».
Для определения содержания бензойной кислоты и
тиомочевины в контрольных растворах зарегистрировали электронный спектр
поглощения раствора бензойной кислот и раствора тиомочевины (концентрации
составляли 1·10-4М) в интервале длин волн 190-400 нм с помощью
программы «UVProbe» c коррекцией базовой
линии по «холостой пробе» (сравнительная кювета с дистиллированной водой).
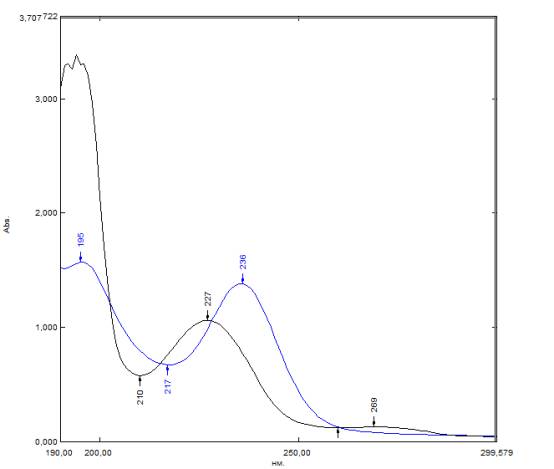
Полученные данные представлены на рис. 1 (черным цветом изображен спектр
поглощения бензойной кислоты, синим – тиомочевины).
По данным
рис. 1 выбрали длины волн для построения калибровочного графика A=f(c),
соответственно λ1=210 нм для бензойной кислоты и λ2=236
нм для тиомочевины.
Для
определения концентрации растворов использовали спектрофотометрический метод -
метод калибровочного графика A=f(c).
В таблице 1 приведены данные оптических плотностей и соответствующие им
концентрации бензойной кислоты.
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
|
А |
0,346 |
0,431 |
0,659 |
0,810 |
1,252 |
|
С, 10-5 М |
1.0 |
2.0 |
4.0 |
6.0 |
10.0 |
Таблица 1 Зависимость
оптической плотности от концентрации бензойной кислоты.
Рисунок
1 Наложение спектров бензойной кислоты и тиомочевины.
На рис. 2
представлен калибровочный график концентрации от оптической плотности бензойной
кислоты.
В
качестве контрольного образца использовали раствор бензойной кислоты с
концентрацией 3·10-5 М, данная концентрация соответствует данным
калибровочного графика.
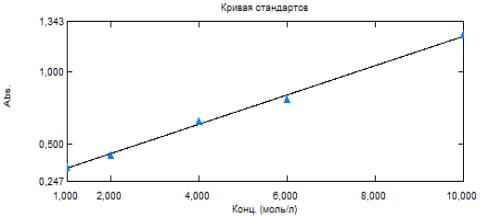
Рисунок 2 Зависимость
оптической плотности от концентрации раствора бензойной кислоты.
Для построения калибровочного графика
зависимости концентрации тиомочевины от оптической плотности готовилась серия
растворов с концентрациями от 1·10-5 М до 10·10-5 М. На
спектрофотометре «UV-1800 Shimadzu» измерялась оптическая
плотность растворов. Данные приведены в таблице 2.
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
|
А |
0,104 |
0,130 |
0,193 |
0,248 |
0,388 |
|
С, 10-5 М |
1.0 |
2.0 |
4.0 |
6.0 |
10.0 |
Таблица
2 Зависимость оптической плотности от концентрации тиомочевины.
На рис. 3 представлена зависимость оптической
плотности от концентрации раствора тиомочевины A=f(c).
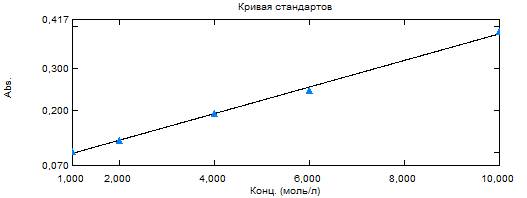
Рисунок 3 Зависимость
оптической плотности от концентрации тиомочевины.
Далее представляло интересным определение
бензойной кислоты и тиомочевины в водных растворах при их совместном
присутствии. Для их определения были приготовлены стандартные растворы
бензойной кислоты и тиомочевины с концентрацией 1·10-4 М на фоне
0.01 М раствора NaOH, просканированы электронные спектры
растворов бензойной кислоты и тиомочевины в режиме наложения с использованием
программы «UVProbe». Данные представлены на рис.6 (черной линией
изображен спектр тиомочевины, красным – бензойной кислоты).
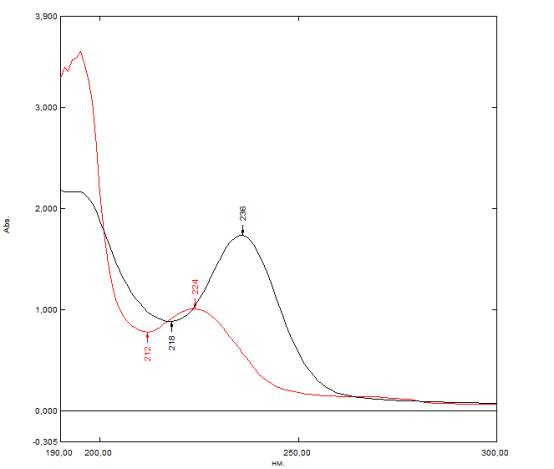
Рисунок 4 Электронные
спектры бензойной кислоты и тиомочевины в режиме наложения спектров.
Как видно из рисунка 4 ход кривых поглощения
наиболее сильно отличается при λ1=236 нм для тиомочевины и
λ2=212 нм для бензойной кислоты. Замерили оптическую плотность
растворов с концентрациями 10-4М при λ1=236 нм и
λ2=212 нм для обоих растворов, при этом оптические плотности
бензойной кислоты и тиомочевины соответственно равны А бенз.к-ты 236=
0,578; А бенз.к-ты 212=0,776 и Атиомоч.236=1,741; Атиомоч.212=
1,007. Высчитали молярные коэффициенты поглощения по закону
Бугера-Ламберта-Бера, который в логарифмическом виде имеет вид:
![]() ,
,
где Аl - оптическая плотность раствора при выбранной длине волны l, нм; el - мольный коэффициент поглощения при выбранной длине волны l; С – концентрация поглощающего вещества, моль/л; l – толщина поглощающего слоя,
см. Молярные
коэффициенты для бензойной кислоты соответственно равны Ɛ236=5780,
Ɛ212= 7760, а для тиомочевины Ɛ236=17410,
Ɛ212= 10070.
В качестве контрольного
образца использовали приготовленный
раствор бензойной кислоты и тиомочевины при их совместном присутствии с
концентрацией 10-4 М, измерили оптическую плотность при λ1=236
нм и λ2=212нм,
оптические плотности равны А236=2,319 и А212=1,783.
В частности, в случае двух поглощающих веществ Х и Y для определения их концентрации в растворе нужно решить систему
уравнений, записанных для двух длин волн l1 и l2:
![]()
![]()
![]()
![]()
![]()
![]()
Подставив значения получим:
![]()
![]()
![]()
Проведя математические вычисления, получаем, что Сбенз.к-ты=10-4М
и Стиомоч=10-4М.