Экология /4. Промышленная экология и медицина труда
К. м. н.Тарских М.М.
Красноярский государственный педагогический
университет им. В.П.Астафьева
Исследование механизмов
повреждающего действия промышленного мономера акриламида
Аннотация: острое отравление акриламидом крыс в дозе 1,4
ммоль/кг (100 мг/кг, 4/5 от LD50) вызывало стимуляцию перекисного окисления
липидов (ПОЛ) в крови, в гомогенате и
субклеточных фракциях печени, а также в гомогенате головного мозга отравленных
животных. Отмечалось также снижение общего содержания цитохрома Р-450 в микросомах
печени крыс при данных условиях опыта. Сделан вывод о том, что акриламид
является мембранотоксином с
проксидантным механизмом действия
Ключевые слова: акриламид, острое
отравление, ПОЛ.
Annotation: acute poisoning by
acrylamide of rats in the dose of 1,4 mmole/kg (100 mg/kg, 4/5 from LD50)
caused the stimulation of the peroxide oxidation of lipids( LPO) in the blood,
in homogenate and subcellular fractions of the liver, and also in homogenate of
the brain of the poisoned animals. Was noted also a reduction of the common
content of cytochrome P -450 in the microsomes of the liver of rats with the
given experimental conditions. The conclusion is made that acrylamide appears
membranotoksin by stimulator of the peroxide oxidation of lipids ( LPO).
Keywords: acrylamide, acute poisoning, LPO.
Введение
Акриламид (АА) широко используется в
различных отраслях промышленности. Контакт с ним имеют сотни тысяч людей во
всем мире на производстве и в быту [7] . Целью настоящего исследования было
изучение влияния АА на перекисное окисление липидов (ПОЛ) в различных органах
крыс на экспериментальной модели острого отравления мономером.
Материалы и методы
Работа выполнена на 160 белых беспородных крысах-самцах массой
150 – 200г. Содержание, питание, уход
за животными и выведение их из эксперимента осуществляли в соответствии с
требованиями «Правил проведения работ с использованием экспериментальных
животных» (Приложение к приказу МЗ СССР от 12.08.1977г. №755). Экспериментальная
модель острого отравления крыс АА создавалась однократным внутрибрюшинным
введением АА на физиологическом растворе в дозе 1,4 ммоль/кг (100 мг/кг, 4/5 от
LD50) [3,7]. Печень промывали при 0 - 4ºС через нижнюю полую вену холодным
1,15% раствором KCl, содержащим 100 мМ трис-HCl буфер, рН 7,4, измельчали,
гомогенизировали в гомогенизаторе Даунса. Фракционирование субклеточных
препаратов производили методом дифференциального центрифугирования [6]. Аналогичным
образом приготовлялся гомогенат головного мозга. Исследование роли ПОЛ проводилось в органах с различной
тропностью к АА путем оценки
зависимости «время–эффект», причем регистрировалось не просто содержание
малонового диадельгида (МДА) – одного из важнейших промежуточных
продуктов перекисного окисления [2], а оценивалась скорость протекания процесса
ПОЛ в органах отравленных животных.
Полученные результаты
обрабатывались статистически с помощью вычисления средней арифметической (М) и
стандартной ошибки средней арифметической (m). Достоверность различий
сравниваемых параметров рассчитывали с использованием t – критерия Стьюдента.
Различия считались значимыми при Р<0,05. Математический расчет выполнялся с
помощью статистической программы «Microsoft Excel»
Результаты
Результаты
экспериментов показали, что после однократного внутрибрюшинного введения АА в
дозе 4/5 от LD50 (1,4 ммоль/кг) содержание МДА увеличивалось в плазме
крови отравленных крыс уже через 1 час с момента введения яда (р< 0,05),
оставаясь на высоком уровне спустя 3 часа с начала затравки (табл. 1). Аналогичный
эффект отмечался и в клетках красной крови отравленных АА крыс, правда
статистически значимое увеличение МДА в эритроцитах опытных животных отмечалось
несколько позже – через 3 часа после введения акрилата (табл.1).
Таблица 1.
Влияние острого отравления акриламидом (АА) на
содержание МДА в крови крыс
|
Время после введения АА, часы |
Содержание МДА, нмоль/мл плазмы |
Содержание МДА, нмоль/мг Нв эритроцитов |
|
Контроль |
10,0 ± 1,0 |
0,24
± 0,05 |
|
1 |
15,7 ± 0,6* |
0,34
± 0,03 |
|
3 |
16,3 ± 2,5* |
0,38 ± 0,30*** |
|
12 |
9,3 ± 1,2 |
0,20
± 0,01 |
|
24 |
10,9 ± 1,0 |
0,40 ± 0,11 |
Примечание: 0, 1мл упакованных эритроцитов (1000g в течение 10
мин.) и 0,5 мл плазмы разводились
равными объемами физиологического раствора, после чего без инкубации
определялось содержание МДА.
Учитывая
современные данные о том, что индукторами гемолиза эритроцитов являются продукты
перекисного окисления [1], можно предположить, что именно стимуляция ПОЛ в
эритроцитах при остром отравлении АА может лежать в основе его гемолитического
действия и способствует снижению кислотной устойчивости эритроцитов, показанной
ранее [4] .
Следующая
серия экспериментов была посвящена изучению роли ПОЛ в патогенезе
гепатотоксического действия АА. Результаты проведенных опытов представлены в
таблице 2.
Таким образом, как
видно из таблицы 2, острое отравление АА вызывало стимуляцию перекисного
окисления липидов в печени опытных животных уже через 3 часа после введения
мономера (р<0,05).
Таблица 2.
Влияние острого отравления акриламидом (АА) на
скорость образования
малонового диальдегида (МДА) гомогенате печени крыс
|
Время начала введения АА, часы |
Скорость образования МДА, нмоль/мг белка за 30 мин. |
|
Контроль |
0,23
± 0,03 |
|
1 |
0,31
± 0,05 |
|
3 |
0,34 ± 0,03* |
|
12 |
0,42 ± 0,04* |
|
24 |
0,28
± 0,04 |
Примечание: инкубационная смесь, термостатируемая при 37ºС
в 2,1мл объема содержала: 100мМ трис–НCl буфер,
рН 7,4; 4 мг/мл белка гемогената печени.
Максимальный эффект приходился на 12 часов с начала
затравки, о чем свидетельствует наибольшая скорость образования МДА в этом
органе в данный период времени (р<0,05). В то же время АА стимулировал скорость
образования МДА в митохондриальной фракции, а также ферментативное ПОЛ в
изолированных микросомах, о чем свидетельствует обнаружение
прооксидантного эффекта яда при добавлении НАДФН к микросомам отравленных АА крыс
(табл. 3). Кроме того, это сопровождалось снижением содержания цитохрома Р–450 в микросомах отравленных АА
крыс (через 3 часа после введения) по сравнению с контрольными, что, по всей
видимости, обусловлено деструктивным действием промежуточных продуктов
перекисного окисления на микросомальный гемопротеид (табл. 4).
Таблица 3.
Влияние острого отравления акриламидом (АА) на
скорость образования малонового диальдегида (МДА) в субклеточных фракциях
печени крыс
|
Серия эксперимента |
Время начала введения АА, часы |
Скорость образования МДА, нмоль/мг белка за 30 мин. |
|
|
Контроль |
АА |
||
|
Постмитохондриальная надосадочная
жидкость |
3 |
0,40 ± 0,08 |
0,43 ± 0,05 |
|
Микросомы |
3 |
0,27 ± 0,03 |
0,21 ± 0,03 |
|
Микросомы |
12 |
0,19 ± 0,03 |
0,22 ± 0,04 |
|
Микросомы + НАДФН, 1мм |
12 |
0,63 ± 0,02 |
0,76 ± 0,02* |
|
Митохондрии |
12 |
0,17 ± 0,03 |
0,33 ± 0,04* |
Примечание: инкубационная смесь, термостатируемая при 37ºС в 2,1мл объема
содержала: 100мМ трис–НСI буфер, рН 7,4; 4 мг/мл белка микросом или
митохондрий, или 2 мг/мл белка постмитохондриальной надосадочной жидкости
печени, а также 1мМ НАДФН при изучении ферментативного ПОЛ в микросомах.
Таблица 4.
Влияние острого отравления акриламидом (АА) на
содержание цитохрома
Р–450 в микросомах печени крыс
|
Серия эксперимента |
Содержание цитохрома Р-450, нмоль/мг белка микросом |
|
Контроль АА |
0,33 ± 0,002 0,30 ± 0,002* |
Примечание: инкубационная смесь, термостатируемая при 37ºС
в 2,1мл объема содержала: 100мМ трис–НСI буфер, рН 7,4; 4 мг/мл белка микросом,
1мМ НАДФН.
Полученные результаты свидетельствуют о
важной роли ПОЛ в патогенезе гепатотоксического действия АА.
Далее, исходя из полученных данных о нейротоксическом действии АА [5] нами в следующей серии опытов исследовалось влияние
острого отравления акрилатом крыс на скорость перекисного окисления липидов
биомембран головного мозга крыс (табл. 5).
Таблица 5.
Влияние острого отравления акриламидом (АА) на
скорость образования малонового диальдегида (МДА) в гомогенате головного мозга
крыс
|
Время после введения АА, часы |
Скорость образования МДА, нмоль/мг белка за 30 мин. |
|
Контроль |
0,40
± 0,18 |
|
3 |
0,36
± 0,03 |
|
6 |
0,29
± 0,11 |
|
12 |
0,52
± 0,06 |
|
24 |
0,93 ± 0,20* |
Примечание: инкубационная смесь термостатируемая при 37ºС в
2,1 мл объема содержала:
100мМ трис–НCl буфер, рН 7,4; 1 мг/мл белка гомогената головного мозга.
Приведенные в таблице
данные свидетельствуют о стимуляции перекисного окисления липидов биомембран
головного мозга крыс при остром отравлении АА, судя по увеличению скорости
образования МДА в гомогенате этого органа через 24 часа после введения мономера
(р<0,05). Это указывает на возможную связь перекисного окисления липидов с
нейротоксичностью АА.
Таким
образом, совокупность полученных результатов свидетельствует о том, что острое
отравление АА ведет к стимуляции перекисного окисления липидов в ряде органов:
крови, печени, головном мозге животных. Сопоставление временной динамики развертывания этих процессов
показывает, что увеличение содержания продуктов перекисного окисления липидов
происходит ранее всего в плазме крови — через 1 час, затем в
эритроцитах — через 3 часа после введения АА, в гепатоцитах — через 3
часа, и наконец, в головном мозге опытных животных — через 24 часа после
инъекции яда (рис. 1).
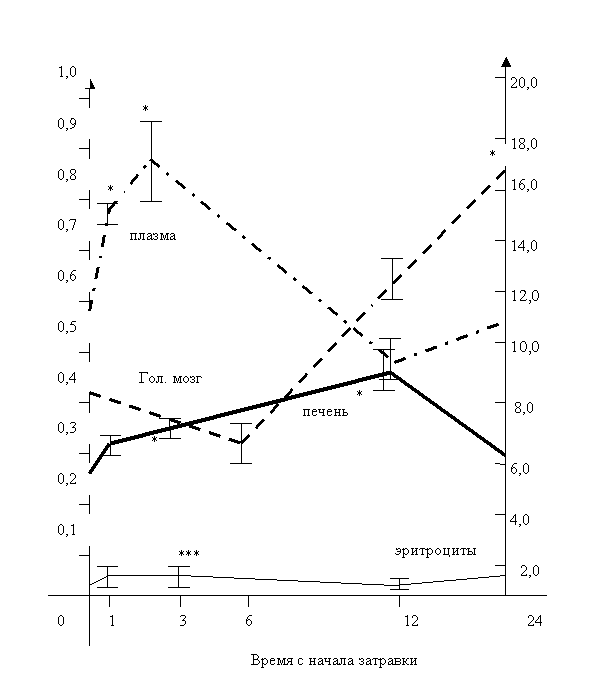
Рисунок 1. Динамика изменений скорости
образования МДА в органах и содержания МДА в крови крыс при остром отравлении
акриламидом (АА)
Примечание: инкубационная смесь, термостатируемая при 37°С в 2,1
мл объема содержала: 100 мМ трис-HCl буфер, рН
7,4; 4 мг/мл белка гомогената печени или 1 мг/мл белка гомогената головного
мозга контрольных и отравленных животных. 0,1 мл упакованных эритроцитов (1000 g в течении 10 мин) и 0,5 мл плазмы разводились равными
объемами физиологического
раствора, после чего без инкубации
определялось содержание МДА.
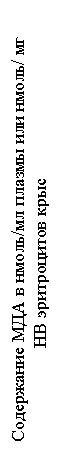
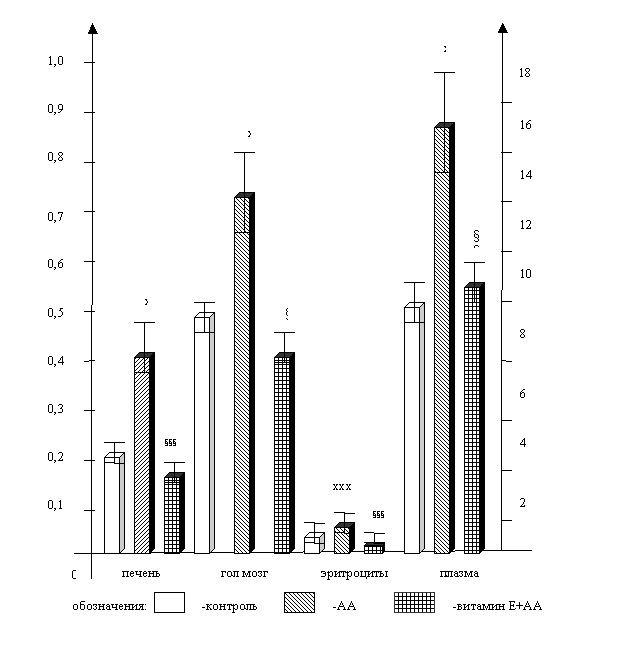
Рисунок 2. Влияние витамина Е на скорость
образования МДА в органах и
содержание МДА в крови крыс при остром отравлении
акриламидом (АА).
Примечание: х — р < 0,05;
хх — р < 0,01; ххх — р < 0,001 — достоверность отличий по сравнению с
контролем; § — р < 0,05; §§
— р < 0,01; §§§
— р < 0,001
— достоверность отличий опытов на фоне предварительного (до отравления АА)
введения витамина Е с опытами, где животным вводился один АА.
Серьезным
аргументом, подтверждающим приведенные выше данные о важности прооксидантного
компонента в механизме повреждающего действия АА является предотвращение
нарастания скорости накопления МДА в органах и в крови
отравленных животных на фоне предварительного введения природного антиоксиданта
витамина Е (рис. 2).
На рисунке 2 приведены результаты опытов,
свидетельствующие о снижении до контрольных уровней скорости образования МДА в
печени, головном мозге, и содержание его в плазме и эритроцитах опытных крыс в
результате предварительного введения антиоксиданта. Интервалы времени после
затравки животных АА, использованные при изучении вышеуказанных показателей,
соответствовали максимальному прооксидантному эффекту яда в этих тканях (рис. 1).
Выводы
1. Промышленный мономер АА является мембранотоксином с
прооксидантным механизмом действия, о чем сидетельствует стимуляция перекисного
окисления липидов биомембран в крови, печени и головном мозге отравленных
животных.
2.Антиоксиданты могут быть использованы в качестве
меры химиопрофилактики токсических эффектов акрилата.
Литература
1.Владимиров Ю.А., Арчаков
А.И. Перекисное окисление липидов в биологических мембранах – М.:Наука,1972. – 252с.
2.Гаврилов В.Б., Гаврилов А.Р., Мажуль Л.М. Анализ методов
определения продуктов перекисного окисления липидов в сыворотке крови по тесту
с тиобарбитуровой кислотой // Вопр.
мед. химии. – 1987. – 33 (1) –
С.118–22.
3.Иванов В.В., М.М.Тарских, М.В. Яманова
Этан выдыхаемого воздуха в оценке стабилизации мембран клеток печени при интоксикации
акрилатами //Реконструкция,
стабилизация и репарация биомембран. – Благовещенск, 1989. – С.126.
4.Тарских М.М.. Повреждение мембран
эритроцитов в механизме токсического действия акрилатов // Бюллетень
экспериментальной биологии и медицины. Москва,
2006, №12, стр. 646-648.
5.Тарских М.М., Климацкая Л.Г., Колесников С.И. Исследование нейротоксичности
акрилатов в эксперименте и у рабочих акрилонитрильного производства //
Бюллетень восточно-сибирского научного центра. – Иркутск, 2012. №3(85), часть
2. – С.316-318.
6..Мэдди Э. Биохимическое исследование
мембран. - М., - 1979. – С. 5–57.
7..Acrylamide. Environmental Health criteria 49. Geneva: WHO. – 1989. – P.34.