Піменов Д. О.
Бердянський державний педагогічний
університет
Вивчення
процесів у реальних та ідеальних газах із застосуванням комп’ютерної графіки
При вивченні процесів у реальних та ідеальних газах
виникає необхідність у графічному їх відображенні та у розрахунку
термодинамічних параметрів і потенціалів. Наявність графічних ілюстрацій
процесів, які представлені у будь-яких термодинамічних координатах сприяє більш глибокому розумінню фізики процесу. У зв’язку з цим визначена мета
даної роботи: написання інтерактивного програмного забезпечення для вивчення процесів у
реальних та ідеальних газах.
У
створеному програмному забезпеченні можливо моделювати процеси з реальними та
ідеальними та газами у таких системах координат: PV, VT, PT, ST. Систему координат обирає користувач за допомогою
перемикачів, які розташовані на панелі інструментів. Також він обирає тип газу,
кількість речовини та інші початкові параметри.
Графік
процесу, який вивчається з ідеальним або реальним газом, створюється за
допомогою маніпулятора миші наступним чином. Користувач, рухаючи його з
затисненою лівою кнопкою, моделює графічне зображення процесу, який
відбувається з газом. Натиснувши праву кнопку миші можливо замкнути створений
процес. При цьому координати курсору миші (припустимо P і V) потрапляють до
масиву. Виразив температуру T із рівняння Клапейрона – Менделєєва для ідеальних газів
або з рівняння Ван-дер-Ваальса для реальних газів, отримаємо третій параметр
стану газу. Таким чином, маючи масив із PVT координат, ми можемо перебудувати намальований маніпулятором
миші графік процесу в інші можливі термодинамічні 2D
або 3D координати.
У програмі можливо для конкретного газу та конкретно заданого процесу
розрахувати усі термодинамічні потенціали (внутрішню енергію - U, ентропію - S, ентальпію - H, енергію
Гіббса - G, вільну енергію Гельмгольца F ) за відомими формулами та графічно
представити їх у вигляді залежностей від термодинамічних параметрів (тиску - p, об’єму - V, температури – T ).
Діалоговий інтерфейс програми дозволяє відкрити, зберегти та роздрукувати
створені та перебудовані графіки залежностей, побачити та записати у файл
значення усіх термодинамічних параметрів та потенціалів у кожній точці процесу,
їх максимальні та мінімальні значення.
Можливості програми проілюструємо на наступних прикладах.
1. Побудуємо
ізобару (синій колір) та ізохору (зелений колір) в PV системі та перебудуємо у ST
систему. Отримаємо результат, який зображений на рис. 1.
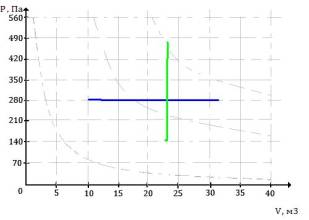
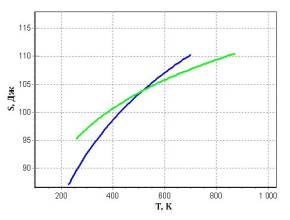
Рис 1. Ізобара та ізохора у PV і ST системах координат.
Із рисунку 1 у ST системі бачимо, що
ізобара більш швидше зростає ніж ізохора, оскільки при ізобарному процесі вся
кількість теплоти наданій системі ∂Q=TdS витрачається на збільшення її внутрішньої енергії dU та на здійснення роботи ∂A, а при ізохорному -
тільки на збільшення внутрішньої енергії dU.
2. Термодинамічний потенціал Гіббса G - функція стану системи, яку визначається наступним чином: ![]() Її повний
диференціал дорівнює:
Її повний
диференціал дорівнює: ![]()
Як бачимо, термодинамічний потенціал G можна
розглядати як характеристичну функцію параметрів (p,T) звідки випливає, що
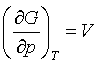 ;
; 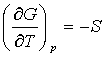 .
.
Якщо T і p залишаються сталими, маємо нерівність:
![]()
![]() , звідки випливає, що необоротний процес у системі за
цих умов супроводжується зменшенням її термодинамічного потенціалу, який в
рівноважному стані є мінімальний. Переконаємося у цьому.
, звідки випливає, що необоротний процес у системі за
цих умов супроводжується зменшенням її термодинамічного потенціалу, який в
рівноважному стані є мінімальний. Переконаємося у цьому.
Змоделюємо у програмі ізотерму в VT
системі, збільшуючи об’єм, та перебудуємо в Gp систему координат (рис. 2).
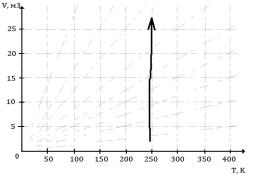
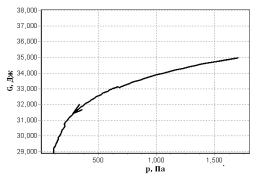
Рис. 2 Умови рівноваги та
стійкості
Згідно з виразом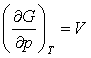 , перша похідна від енергії Гіббса за тиском при
постійній температурі позитивна та дорівнює об’єму V. Отже, залежність енергії Гіббса від тиску при постійній
температурі зростаюча. Друга похідна - від’ємна. Отже функція f=G(p) є
впуклою. Так і є.
, перша похідна від енергії Гіббса за тиском при
постійній температурі позитивна та дорівнює об’єму V. Отже, залежність енергії Гіббса від тиску при постійній
температурі зростаюча. Друга похідна - від’ємна. Отже функція f=G(p) є
впуклою. Так і є.
Процес на рисунку 2
супроводжується зменшенням потенціалу Гіббса, а отже система прагне до
рівноваги.
Висновок: створена комп’ютерна програма
сприяє більш глибокому та швидкому сприйняттю розділів фізики пов’язаних з
властивостями реальних та ідеальних газів.
Література
1. Архангельский А.
Я. Программирование в С++ Builder 6./
А. Я. Архангельский – М.: «Издательство БИНОМ» 2003 г. – 1152 с.
2.
Школа О.В. Основи термодинаміки і статистичної фізики: навчальний посібник [для
студ. вищ. навч. закл.] / О.В.Школа. – Донецьк: Юго – Восток, 2009. – 375 с.