Коровашкина
А.С., Квач С.В., Зинченко А.И.
Институт
микробиологии НАН Беларуси, Минск
Конструирование
рекомбинантной плазмиды, содержащей многокопийный CpG-мотив
CpG-мотивы
представляют собой особые шестичленные нуклеотидные последовательности,
содержащие в центральной своей части CpG-динуклеотид. Такие последовательности в 20 раз чаще
встречаются в микробной ДНК, чем в ДНК человека и животных. Кроме того, в
отличие от микроорганизмов, цито-зин в CpG-динуклеотидах эукариот метилирован. CpG-мотивы узнаются TLR9-рецепторами иммунокомпетентных клеток
(В-клетки, макрофаги, дендритные клетки и др.) и стимулируют неспецифический
иммунитет человека и животных против инфекционных патогенов, проявляют
противоопухолевые и противоаллергенные свойства, а также обладают адьювантной
активностью [1–3]. Для человека наиболее эффективной последовательностью
является GTCGTT, а для мышей и кроликов – GACGTT [1].
В настоящее время используются в
основном химически синтезирован-ные олигодезоксинуклеотиды, содержащие CpG-мотивы у которых природная фосфодиэфирная
межнуклеотидная связь заменена на фосфоротиоатную, поскольку такая связь более
устойчива к действию нуклеаз [4, 5]. Фосфоро-тиоатная модификация углеводного
скелета CpG-мотивов повышает
их способность стимулировать В-лимфоциты, однако при этом, снижает
эффективность стимуляции NK-клеток [6] и усиливает токсичность [7, 8].
Важно,
что повторение несколько раз мотива в пределах ОДН повышает его
иммуностимулирующую активность [9]. Известны ДНК-вакцины, представляющие собой плазмиды, несущие гены,
кодирующие те или иные чужеродные для организма-хозяина белки. В ряде случаев,
для усиления иммуногенности в плазмиды встраивают несколько копий CpG-мотивов. Так, в ДНК-вакцины против вируса
геморрагической септицемии встроены 2 и 4 копии фрагмента, содержащего 12
мотивов GTCGTT, 5 мотивов GACGTT и 1 мотив AACGTT [10].
Известна плазмида pYES2-90CpG, содержащая 90 различных CpG-мотивов. В частности, она содержит 5
повторов тандема, составленного из 12 мотивов GTCGTT, 5 мотивов GACGTT и 1 мотива AACGTT (в сумме – 90 различных CpG-мотивов). Плазмида нарабатывалась в
штамме-реципиенте Escherichia coli-Top10 фирмы Invitrogen для изучения ее влияния на иммунитет рыб и креветок [11].
Целью данной работы явилось конструирование плазмидных ДНК, обогащенных CpG-мотивами, и пригодной для клонирования этих нуклеотидных
последовательностей в клетках Escherichia coli.
Предполагается, что такие конструкции могут использоваться как адьюванты, а
также для иммунотерапии и иммунопрофилактики инфекционных, онкологических и
аллергических заболеваний.
Объекты и методы исследования. Для получения ДНК, содержащей CpG-мотивы, химически синтезировали прямую (CpG-F) и обратную (CpG-R) цепи олигодезоксинуклеотидов (ОДН) (жирным выделен участок,
содержащий 4 повтора CpG-мотива, италика – сайт узнавания рестриктазы HindIII).
CpG-F: 5′- AGCTTCGTCGTTTTGTCGTTTTGTCGTTTTGTCGTTA-3′
CpG-R: 5′-AGCTTAACGACAAAACGACAAAACGACAAAACGACGA-3′
Для отжига ОДН реакционную
смесь, содержащую CpG-R и CpG-F, прогревали при 95°C, а затем охлаждали до 4°C.
Фосфорилирование 5′-концов полученного дуплекса осуществляли с помощью
Т4-полинуклеотидкиназы. Самолигирование дуплекса проводили по «липким концам»,
соответствующим сайтам узнавания рестриктазы HindIII, с помощью T4-лигазы. Продукт лигирования (двухцепочечный
полидезоксинуклеотид; dsCpG-полинуклеотид) выделяли с помощью электрофореза в 1%-ном
агарозном геле и амплифицировали, используя ПЦР. Полученные CpG-полинуклеотиды
лигировали с Т-вектором, приготовленным на основе плазмиды pXcmkn12 (Сloning Vector Collection, Япония) путем ее обработки рестриктазой XcmI (New England Biolabs, США) в течение 12 ч при 37ºС.
В результате была
сконструирована плазмида pCpG-KH11,
обогащенная иммуностимулирующими мотивами GTCGTT. Наличие и размер вставки подтверждали
методом рестрикционного анализа. Путем последующей
трансформации плазмидой pCpG-KH11
клеток Escherichia coli BLR(DE3)
(Novagen,
США) был получен рекомбинантный
штамм E.
сoli pCpG-KH11 – продуцент плазмиды,
обогащенной CpG-мотивами.
Клетки E.
coli pCpG-KH11 выращивали при 37оС
в течение 16 ч на среде следующего состава: триптон – 1,0%; дрожжевой экстракт
– 0,5%; глицерин – 0,5%; глюкоза – 0,05%; Na2HPO4 – 0,025 М; KH2PO4 – 0,025
М; NH4Cl – 0,05 М; Na2SO4 – 0,005 М; MgSO4 – 0,002 М; FeCl3
– 50 мкМ; CaCl2 – 20
мкМ; MnCl2 – 10
мкМ; ZnSO4 – 10
мкМ; CoCl2 – 2 мкМ;
CuCl2 – 2 мкМ;
NiCl2 – 2 мкМ,
Na2MoO4 – 2 мкМ; Na2SeO3 – 2 мкМ,
H3BO3 – 2 мкМ; ампициллин – 150 мкг/мл; (pH 7,0). Продуктивность штамма
в отношении плазмиды pCpG-KH11 определяли после выделения
плазмиды из клеток стандартным методом щелочного лизиса.
Результаты и
их обсуждение. Одним из наиболее перспективных подходов к практическому
использованию CpG-мотивов
в иммунологии является встраивание этих нуклеотидных последовательностей в плазмиды
с последующим введением таких векторных конструкций в организм человека или
животных. В результате выполнения данной работы сконструирован плазмидный
вектор pCpG-KH11, обогащенный мотивом GTCGTT, который,
по литературным данным, наиболее эффективно стимулирует иммунную систему
человека [11]. Схематическое изображение плазмиды pCpG-KH11 представлено на рисунке 1.
Наличие в плазмиде встроенных
тандемных повторов CpG-мотивов
подтверждено методом рестрикционного анализа. С этой целью плазмидную ДНК инкубировали со смесью рестриктаз NdeI и EcoRI, сайты узнавания которых ограничивают клонированный участок.
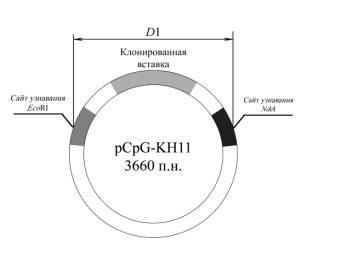
Рисунок 1 – Схематическое изображение плазмиды pCpG-KH11
Полученные в результате рестрикции
фрагменты затем обработали рестриктазой HindIII, сайты рестрикции которой находятся внутри
клонированного участка. Анализ продуктов рестрикции проводили путем
электрофореза в 1%-ном агарозном геле (рисунок 2).
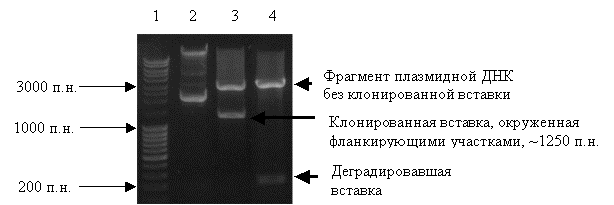
Рисунок 2 – Электрофоретический
анализ рестриктов плазмиды рCpG-KH11
1 – фрагменты ДНК c известным количеством пар нуклеотидов;
2 – очищенная
плазмида рCpG-KH11;
3 – фрагменты
ДНК, полученные после обработки рCpG-KH11 смесью рестриктаз NdeI и EcoRI;
4 – фрагменты ДНК, полученные после обработки рCpG-KH11 смесью
рестриктаз NdeI, EcoRI и HindIII.
Число клонированных в плазмиде рCpG-KH11 CpG-мотивов, составляющее 96, определяли по формуле:
![]() ,
,
где:
D1 – размер
фрагмента, полученного в результате обработки рCpG-KH11 смесью
рестриктаз NdeI и EcoRI и состоящего из клонированной
вставки, окруженной фланкирующими участками (п.н.);
280 – суммарный размер фланкирующих
участков (п.н.);
40 – размер 1 тандемного повтора CpG-мотивов (п.н.);
4 – количество CpG-мотивов в 1 тандемном повторе.
В результате проведенных экспериментов по
молекулярному клонированию получен штамм-продуцент плазмидной ДНК, обогащенной
иммунотропными CpG-мотивами, названный E. coli CpG-KH11. Данный штамм способен продуцировать плазмидную ДНК
в количестве 5,5–6,0 мг/л.
Заключение. В результате выполнения
данной работы сконструирован вектор рCpG-KH11, несущий 96
повторов иммунотропного CpG-мотива GTCGTT. Судя по литературным данным, полученная плазмида может использоваться как адьювант для
повышения эффективности белковых и ДНК-вакцин, а также для терапии и
профилактики инфекционных, онкологических и аллергических заболеваний.
Литература:
1. Krieg A.M. CpG motifs in bacterial DNA and their immune effects //
Ann. Rev. Immunol. – 2002. – Vol. 20. – P. 709–760.
2. Олишевский С.В., Козак В.В., Яниш Ю.В.,
Рыбалко С.Л., Шляховенко В.А. Иммуностимулирующая CpG-ДНК: перспективы
клинического применения в онкологии // Онкология. – 2006. – Т. 8, № 2. – С.
209–217.
3. Pat. 7935675 US, Immunostimulatory nucleic acid molecules, 2011.
4. Zhao Q.,
Temsamani J., Iadarola P.L., Jiang Z., Agrawal S. Effect of different
chemically modified oligodeoxynucleotides on immune stimulation // Biochem. Pharmacol.
– 1996. – Vol. 51. – P. 173–182.
5. Pat. 6727230 US. Immune
stimulation by phosphorothioate oligonucleotide analogs, 2004.
6.
Carpentier A.F., Auf G., Delattre J.Y. CpG-oligonucleotides
for cancer immunotherapy: review of the literature and potential applications
in malignant glioma // Front. Biosci. – 2003. – Vol. 8. – P. 115–127.
7. Sparwasser T., Hültner
L., Koch E.S., Luz A., Lipford G.B., Wagner H. Immunostimulatory CpG-oligodeoxynucleotides cause extramedullary murine
hemopoiesis // J. Immunol.
1999. Vol. 162. P. 2368–2374.
8. Park B.K., Kim D., Rhee
J.W., Kim M.S., Seok H.J., Choi S.Y., Park J., Lee Y., Kwon H.J. The production and immunostimulatory activity of
double-stranded CpG-DNA // 2010. Vol. 43, N 3. P. 164–169.
9. Hartmann G., Weeratna R.D.,
Ballas Z.K., Payette P., Blackwell S., Suparto I., Rasmussen W.L., Waldschmidt
M., Sajuthi D., Purcell R.H., Davis H.L., Krieg A.M. Delineation of a CpG
phosphorothioate oligodeoxynucleotide for activating primate immune responses in
vitro and in vivo // J.
Immunol. – 2000. – Vol. 164. – P. 1617–1624.
10. Martinez-Alonso
S., Martinez-Lopez A., Estepa A., Cuesta A., Tafalla C. The introduction of multi-copy
CpG motifs into an antiviral DNA vaccine strongly up-regulates its
immunogenicity in fish // Vaccine. – 2011. – Vol. 29, No 6. – P. 1289–1296.
11.
Chen Y., Xiang L.X., Shao J.Z. Construction of a recombinant plasmid containing
multi-copy CpG motifs and its effects on the innate immune responses of aquatic
animals // Fish Shellfish Immunol. 2007. Vol. 23, No 3. P. 589–600.