Химические науки/неорганическая химия
Маматов
Э.Д., Ашуров Н.А., Ятимов П.М., Курбонов А.С., Машаллах Сулаймони., Мирсаидов
У.М..
Институт химии им. В.И.Никитина
АН Республики Таджикистан, 734063, г. Душанбе, пр. Айни, 299/2
ВЫЩЕЛАЧИВАНИЕ ДАНБУРИТОВ
АК-АРХАРА СЕРНОЙ КИСЛОТОЙ
Бор и его соединения играют ведущую роль
при разработке новых материалов с уникальными свойствами. Массовое применение
соединений бора обусловливается двумя факторами: наличием крупных природных
источников сырья и бурным развитием технологии промышленного и
сельскохозяйственного производства.
Данбуриты месторождения Ак-Архар
Таджикистана, имеющие в своем составе кремнезем, данбурит, кальцит,
гидроборацит, аксинит, пироксены и другие минералы, являются прекрасным сырьем для
получения борной кислоты. Содержащиеся в составе данбурита железо, алюминий и
другие компоненты делает его перспективным для комплексного использования.
Ранее в работах [1, 2] нами изучены
взаимодействия данбуритов с соляной кислотой до и после обжига, кинетика процесса, также найдены оптимальные
условия извлечения полезных компонентов, и в работах [3,4] получения борной
кислоты и ее соединений из боратных руд.
Содержание оксидов В, Al, Fe, Са, Мg и Si и др. в
исходном сырье определяли как весовым, так и
комплексонометрическим методами. Содержание щелочных металлов Na и K определяли методом пламенной фотометрии.
Методом рентгенофазового анализа
установлено, что главными рудообразующими минералами исходного данбурита
являются: данбурит, датолит, гидроборацит, аксинит, гранат, пироксены (или
геденбергит), гидрослюда, монтмориллонит, кальцит, кварц и др. Результаты рентгенофазового
и дифференциально-термического анализов исходного и прокаленного данбурита при
температуре 950-980°С приведены на работе [5].
Отличительной чертой сернокислотного
разложения данбурита является избирательность извлечения компонентов. Серная
кислота не реагирует с диоксидом кремния, что позволяет осуществить селективное
разделение кремнезема, CaSO4 и других сульфатов в начале технологического
процесса. При обработке H2SO4
происходит химическое обогащение, в результате которого полезные компоненты -
борная кислота, сульфаты железа и алюминия переходят в раствор.
Установлено, что на селективное действие
по отношению к минералу в руде влияют: продолжительность контакта, концентрация
кислоты, температура и предварительный обжиг данбурита.
Как показывают результаты опытов, одновременно
с разложением данбурита и образованием
дибората кальция, при температуре свыше 950-1000°С данбурит начинает постепенно
расплавляться. Интервал температуры обжига изменялся от 500 до 1050°С. При
температуре 900-1000°С степень извлечения оксида бора и железа значительно
возрастает, составляя: B2O3 – 84.1%
и Fe2O3 – 96.7% в отличие от данбурита без предварительного
обжига. Наиболее благоприятными условиями разложения данбурита серной кислотой
являются следующие условия термической обработки: температура – 950-1000°С; продолжительность обжига – 60 мин. В
оптимальных условиях степень разложения оксидов с последующим обжигом достигает
максимального значения составляя: B2O3 – 85.4% и Fe2O3 – 98.7%
соответственно.
С увеличением температуры процесса степень
разложения оксидов увеличивается при прочих равных условиях при дозировании
серной кислоты от 50 до 300 мас% от стехиометрического количества (рис.6.б). При
расходе 80-100% от стехиометрического количества серной кислоты за 90 минут
были получены оксидов бора с α=0.86
и железа с α=0.97 при температуре 85оС и оксида бора
α=0.87 при температуре 90оС. Результаты проведенных реакций показывают,
что сернокислотное разложение данбурита обеспечивает высокий выход продукта.
Зависимость кинетических кривых сернокислотного
разложения данбурита показывает, что высокая степень выход продукта, прямо пропорциональна
концентрации серной кислоты и температуры, но до определенного предела [Н2SO4=140% от
стехиометрического количества и температура – 950С]. При дальнейшем
увеличении концентрации кислоты и температуры степень извлечения оксидов
снижается.
В первом приближение
кинетические кривые удовлетворительно описываются уравнением первого порядка[6]:
dα /dτ = K (1-α),
где: α- степень извлечения
оксидов; τ - время в минутах; К -
константа скорости реакции сернокислотного разложения, мин-1.
Между энергией
активации (Е), температурой (Т) и
константой скорости реакции (К) существует зависимость, выражаемая уравнением
Аррениуса:
К
= Ко· е-Е/RT
= ![]() или ln K = ln Ko -
или ln K = ln Ko - ![]() ,
,
где: е - основание натуральных логарифмов, Ко-
предэкспоненциальный коэффициент, R
– универсальная газовая постоянная, КДж/моль, град; Т – абсолютная температура,
°К.
Для различных интервалов
температуры были рассчитаны значения К1,К2…и были найдены
их средние значение (Кср).
На рис. 1 приведена зависимость LgКср от обратного значения абсолютной температуры.
Даная зависимость подчиняется корреляционному уравнению
LgKср = -1420,1*(1/Т) + 2,7219 при значении коэффициента
корреляции R2= 0,9869. Как видно из рис 1. полученные
экспериментальные точки при различных температурах удовлетворительно
укладываются на прямую линию Аррениуса, по наклону которой вычислена величина
кажущейся энергии активации.
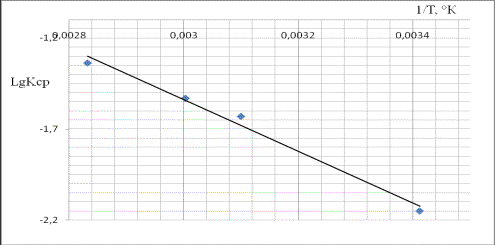
Рис.1. Зависимость LgKср от обратной абсолютной температуры.
Величина энергии активации процесса
сернокислотного разложения данбурита равна 16.68 кДж/моль. Численное значение
энергии активации свидетельствует о прохождении реакции сернокислотного
разложения в смешанной области.
Список
литературы
[1].
Маматов Э.Д., Ашуров
Н.А., Курбонов А.С., Ятимов П., Мирсаидов У.М. - Докл. АН РТ, 2008, т.51, №9,
с.672-677.
[2].
Маматов Э.Д., Ашуров
Н.А., Курбонов А.С., Ятимов П., Мирсаидов У.М.
- Докл. АН РТ, 2008, т.51, №6,
с.356-362.
[3].
Маматов Э.Д., Курбонов
А.С., Машаллах Сулаймони., Мирсаидов У.М.
- Докл. АН РТ, 2010, т.53, №11,
с.865-870.
[4].
Берлин Л.Е. Производство
борной кислоты, буры и борных удобрений. – М.-Л.: Госхимиздат, 1950. - 111 с.
[5].
Маматов Э.Д., Ашуров
Н.А., Мирсаидов У.М. Изучения физико-химических свойств борсодержащих руд
Таджикистана. Матери алы VII-ой межд. конференции« перспективные разработки
науки и техники-2011»-Польша.: Изд. Наука и студио,2011, том 49 с.58-62.
[6].
Эммануэль Н.М., Кнорре
Д.Г. Курс химической кинетики. – М.: Высшая школа, 1974. - 400 с