Біологічні
науки/ 3. Мікологія і
альгологія
Полюх Н.П.
Національний
університет харчових технологій,
Київ, Україна
к.б.н. Ломберг М.Л.
Інститут ботаніки
ім. М.Г.Холодного НАН України, Київ,
Україна
Аналіз радіальної швидкості росту
штамів Coprinus сomatus
на агаризованних поживних
середовищах різного складу
Гнойовик чубатий – С. comatus (O.F.Müll.) Pers – відомий своїми смаковими якостями їстівний гриб, який здавна
використовували в народній медицині, а в промислових об’ємах почали
культивувати починаючи з 1994 р. [1, 2]. Опубліковані дані
свідчать про значний потенціал гриба в лікуванні та профілактиці діабету,
гіпоксемії [3]. Повідомляється про антиоксидантні, імуностимулюючі,
антибактеріальні властивості цього гриба [4]. Унікальність С. comatus обумовлює необхідність вивчення його
біологічних особливостей з метою подальшого впровадження у вітчизняні
біотехнології для отримання цінних метаболітів та міцеліальної біомаси цього
гриба.
Нами
було досліджено динаміку росту 12 штамів C. сomatus різного географічного
положення. Об’єктами досліджень були чисті культури C.comatus, що зберігаються в Колекції культур шапинкових грибів Інституту ботаніки
ім. М.Г.
Холодного НАН України [5]. У
даній роботі були досліджені наступні штами: 137, 138, 173,
1544, 1687, 1727, 1930, 2000, 2141, 2237, 2238, 2278,
причому останні три штами були виділені авторами. Дослідження
проводили на агаризованих поживних середовищах різного складу (СА – сусло агар,
МЕА – мальцекстракт агар, КГА –
картопляно-глюкозний агар, МДПА – мальцдріжджо-пептонний агар, ПА – пептонний
агар, ВА- вівсяний агар, КА – компостний агар), які готували загальноприйнятими
методами [6].
В якості посівного матеріалу використовували активно
ростучі 5-8–добові культури, попередньо вирощені на
картопляно-глюкозному агарі
[7]. Диски міцелію діаметром
5 мм вирізали
стерильною стальною трубкою на відстані 8- 10 мм від краю
активно ростучої колонії. Диски
переносили в центр чашки Петрі діаметром
90 мм з різними
агаризованими середовищами. Посіви
інкубували в
термостаті при температурі 26°С,
точно фіксуючи початок росту (поява міцелію за границями посівного диска). Радіуси колоній вимірювали в двох взаємно перпендикулярних напрямах через добу до полного обростання середовища. Для розрахунку середньої
швидкості радіального
росту (VR, мм/добу) будували криві залежності радіуса міцеліальної колонії
від часу культивування, і
у фазі лінійної залежності приросту радіуса від часу базуючись на даних 8-12
паралельних вимірювань
визначали середню швидкість росту за формулою [7]:
VR =
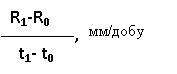
де R1 – радіус колонії в кінці роста, мм; R0 – радіус колонії на початку фази лінійного роста, мм; t1-t0 – тривалість лінійної фази росту, доба.
Для отримання достовірних результатів, експериментальні дослідження в залежності від умов аналізу і вимог математичного
планування, проводили у восьмикратній повторності. В таблицях наведені середньостатистичні достовірні дані при 95%-ій вірогідності. До початку наших
досліджень, інформація про особливості фізіології та морфології
даного виду обмежувалась всього декількома штамами. Для переважної більшості штамів, в тому числі виділених
нами в культуру, така інформація отримана нами вперше.
Узагальнені результати
досліджень 12 штамів C. сomatus на семи агаризованих
поживних
середовищах різного складу наведено у таблиці 1. Дослідження показало, що переважна більшість штамів мали досить високу
радіальну швидкість росту. Штами 2141, 2238, 2237 показали швидкість росту, яка
перевищувала 6 мм/добу. Найбільшу швидкість росту зафіксовано у штама 2238 - 7
мм/добу (рис.1). Оптимальним для швидкоростучих штамів виявилося середовище
МДПА, на якому середня радіальна швидкість росту перевищувала 12,5 мм/добу. Однак
дане середовище не було оптимальним для всіх досліджених штамів.
Таблиця 1.
Середня
радіальна швидкість штамів C. сomatus залежно від складу поживного середовища
(мм/добу)
|
№ штаму |
поживне середовище |
середня швидкість мм/добу |
||||||
|
СА |
МЕА |
КГА |
МДПА |
ПА |
ВА |
КА |
||
|
137 |
1,7±0,1 |
1,6±0,1 |
2,1±0,1 |
1,1±0,2 |
5,3±0,1 |
5,4±0,3 |
4,5±0,1 |
3,1 |
|
1727 |
2,2±0,1 |
2,1±0,1 |
2,9±0,2 |
3,5±0,4 |
4,8±0,1 |
3,2±0,1 |
7,5±0,9 |
3,4 |
|
1930 |
1,6±0,2 |
3,3±0,1 |
3,7±0,1 |
4,1±0,4 |
3,1±0,5 |
4,9±0, 2 |
7,4±0,2 |
4,0 |
|
2000 |
1,8±0,6 |
1,2±0,3 |
1,7±0,1 |
1,2±0,2 |
2,0±0, 3 |
1,4±0,4 |
5,4±0,1 |
2,1 |
|
138 |
1,6±0,1 |
1,7±0,1 |
2,1±0,2 |
0,9±0,1 |
7,1±1,1 |
5,5±0,2 |
6,3±0,9 |
3,6 |
|
173 |
1,5±0,1 |
3,5±0,5 |
3,1±0,3 |
4,1±0,3 |
5,1±0,1 |
5,3±0,1 |
6,6±0,3 |
4,2 |
|
1544 |
2,6±0,1 |
1,7±0,4 |
1,5±0,1 |
4,6±0,1 |
5,5±0,2 |
2,3±0,3 |
7,4±0,5 |
3,7 |
|
1687 |
4,1±0,1 |
2,2±0,1 |
3,6±0,2 |
12,5±0,1 |
5,3±0,1 |
2,2±0,3 |
7,4±1,2 |
5,3 |
|
2237 |
1,4±0,1 |
1,7±0,1 |
3,7±0,2 |
3,9±0,3 |
4,9±0,2 |
5,5±0,1 |
7,7±0,7 |
6,3 |
|
2278 |
3,7±0,1 |
5,3±0,1 |
4,9±0,1 |
13,3±0,4 |
5,1±0,2 |
3,2±0,0 |
7,0±0,5 |
6,1 |
|
2141 |
3,4±0,5 |
5,1±0,1 |
4,8±0,1 |
13,4±0,2 |
1,3±0,2 |
8,0±0,7 |
7,0±0,2 |
6,1 |
|
2238 |
7,7±0,2 |
4,9±0,1 |
4,9±0,1 |
12,6±0,5 |
6,9±0,78 |
5,1±0,2 |
6,7±0,1 |
7,0 |
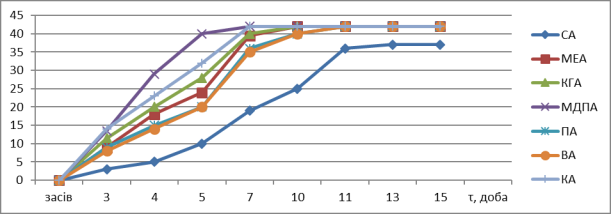
Рис
1. Криві залежності радіусу міцеліальної колонії C. сomatus штаму
2238 від часу культивування
За усередненими значеннями радіальної
швидкості росту ми можемо зробити висновок, що середовище КА виявилося найбільш
оптимальним для росту усіх досліджених штамів C. сomatus. Це
середовище за своїм складом максимально наближене до субстратів з природних
місцезростань даного гриба. Треба відмітити, що
навіть дуже повільно
ростучі штами C. сomatus досить
гарно росли на
компостному агарі. Це дає нам змогу рекомендувати саме
середовище КА, як найбільш оптимальне для міцеліального росту гнойовика
чубатого в чистій культурі.
Література:
1. Денисова Н.П. Лечебные свойства
грибов. Этномикологический очерк. – Санкт-Петербург: СПбГМУ, 1998.- 59 с.
2. Сосин И.К., Мысько Г.Н., Гуревич Я.Л
Немедикаментозные методы лечения алкоголизма //
Киев: Здоров’я. – 2012. – 153 с.
3. Lv
Y., Han L, Yuan C., Guo J. Comparison of hypoglycemic activity of trace
elements absorbed in fermented mushroom of Coprinus
comatus // College of Chemical Engineering, Qingdao University of Science
and Technology, Qingdao, People's Republic of China. – 2009. – Р. 177-185.
4. Elisashvili V.I., Asatiani M.D., Kachlishvili E.T.,.Kenbebashvili N.V, Khardziani T.Sh., Metreveli E.M., Mikiashvili N.A., Songulashvili G.G.,
Tsiklauri N.D. Basidiomicetes as a sourse of Food, Enzyme, Lectins, and Antioxidants // Inter. J. Med. Mushr. – 2009. – 10. – Р. 206.
5. Каталог Колекції культур шапинкових
грибів (ІВК) // А.С.Бухало, Н.Ю.Митропольська, О.Б.Михайлова. – К.: Альтерпрес,
2011. – с. 100
6. Методы экспериментальной микологии: Справочник / под ред.. В.И.Билай. – Киев: Наук.думка, 1982. -583 с.
7. Ломберг М.Л., Соломко
Э.Ф. Рост
культур макромицетов на агаризованных питательных середах и плотных субстратах // В кн.: «Биологические
свойства лекарственных макромицетов в культуре». Киев. – 2012. - Т. 2. - С. 345 – 371.