Биологические науки/8. Физиология
человека и животных
Шевкун Н.А., Сяткин С.П. д.б.н., Демуров Е.А. д.м.н.
Российский
Университет Дружбы Народов (РУДН), Медицинский факультет.
117198
Россия, Москва, ул. Миклухо-Маклая, д. 8.
Фотодинамическая
терапия меланомы у мышей с применением векторного транспортера и
фотосенсибилизатора бактериохлоринового ряда.
Поиск
новых методов доставки лекарств, которые позволили бы значительно повысить эффективность применения традиционных
терапевтических подходов, является
важнейшей задачей современной биологии и медицины. Широкий спектр применяемых в
клинике веществ, таких как фотосенсибилизаторы (ФС), α-эмитеры, нуклеиновые кислоты, относится к локально
действующим, т. к. радиус их активности ограничен несколькими десятками нм.
Накопленные знания о процессах внутриклеточного транспорта макромолекул в
совокупности с известными биологическими особенностями раковых клеток позволили
разработать уникальную систему адресной доставки терапевтических агентов.
Цель
данной работы: оценка эффективности применения конъюгата ФС бактериохлорина с
векторным транспортером для фотодинамической терапии (ФДТ) экспериментальных
опухолей у мышей.
Рекомбинантный
полипептид (векторный транспортер) His6-ДТокс-HMP-
СЯЛ-aМСГ (70,4 кДа) для направленного транспорта ФС в ядра раковых
клеток-мишеней состоит из нескольких структурно-функциональных модулей [1]:
− лиганда к интернализуемому
рецептору, сверхэкспрессированному на клетках меланомы
(последовательности a-меланоцитстимулирующего
гормона aМСГ); −
модифицированного сигнала ядерной локализации (СЯЛ) большого Т-антигена вируса
SV-40 для направления транспорта
конструкции в ядро клетки клетки; − носителя для ФС -
гемоглобиноподобный белок E.coli (HMP); − эндосомолитического модуля
(транслокационный домен дифтерийного токсина ДТокс). Попав в клетку путем рецептор-опосредованного эндоцитоза,
транспортер оказывается «замурованным» в эндосомах. Задачу выхода из замкнутых
везикул в гиалоплазму выполняет данный участок белка, активизирующийся при
низких значениях рН.
Фотодинамическая
терапия рака (ФДТ) в экспериментах in vivo является одним из методов,
позволяющих продемонстрировать эффективность применения транспортеров для
доставки докально-действующих веществ в ядра клеток-мишеней [2].
Фотосенсибилизаторы (ФС), накопившись в опухолевых клетках, при последующем
световом облучении вызывают их гибель путем генерации активных форм кислорода и
свободных радикалов. В медицине ФДТ широко применяется при лечении
злокачественных новообразований и инфекционных заболеваний [3]. Эффективность
фотодеструктивного действия зависит от локализации ФС внутри клетки.
В
данной работе для изучения фотодинамической активности ФС бактериохлорина р,
доставляемого траспортером, использовали мышей линии C57/Black с привитой
сингенной меланомой B16-F1.
Транспортер
был получен путем индуцированной экспрессии в трансформированных клетках
E.coli. Выделение и очистка рекомбинантного белка производилась методом
аффинной хроматографии на Ni-NTA агарозе. Белково-хромофорные коньюгаты
транспортер-ФС получали путем формирования амидных связей между карбоксильными
группами ФС и аминами протеина с использованием N-гидрокси-цукцинимида и
водорастворимого карбодиимида в качестве активаторов. Для проведения ФДТ
меланомы у мышей C57Bl6на 4-ые сутки после инокуляции опухоли (0.5 млн клеток
B16F1) животных разделили на 3 группы –
контроль, инъекция 500 мкл 91,2 мкМ раствора бактериохлорина или аналогичной
дозы бактериохлорина в составе конъюгата с транспортером. Через 3 ч мышей
облучали с помощью иллюминатора с интерферренционным фильтром (максимум
пропускания при 761 нм) 16 мин при удельной мощности светового потока 380
мВт/см2. Сеансы фотодинамической терапии проводили 5 раз, на 4, 6,
8, 11 и 13-е сутки после инокуляции меланомы. Задержку роста опухоли оценивали
по разнице времени достижения опухолью размера контрольной на логарифмической
фазе роста.
В
результате проведения ФДТ с применением внутривенного введения конъюгата
транспортер-бактериохлорин в экспериментах на мышах установлено, что снижение
скорости роста опухоли у мышей с конъюгатом составило 18 ± 0,6 дней по
сравнению с контрольной группой животных, а продолжительность жизни увеличилась
в два раза (Рис. 1). Развитие опухолей в контроле и после ФДТ с использованием
свободного ФС отличается незначительно.
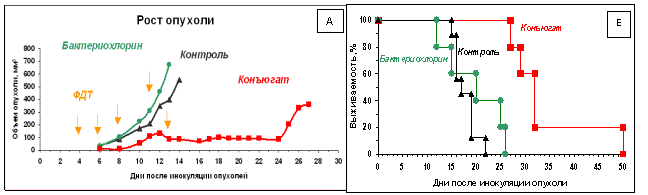

Рис.1. Кинетика роста меланомы B16-F1 (А) и
динамика смертности (Б) у мышей C57/Black после многократной ФДТ.
Таким
образом, продемонстрирована эффективность применения направленной доставки препаратов в клетки опухолей in vivo с применением векторных транспортеров.
Литература:
1.
Соболев А.С., Розенкранц А.А., Гилязова Д.Г. Подходы
к направленной внутриклеточной доставке фотосенсибилизаторов для увеличения их
эффективности и придания клеточной специфичности // Биофизика. – 2004. – № 49
(2) . – с. 351-379.
2.
Baumann A. Early
development of therapeutic biologics // Pharmacokinetics. Current
Drug Metabolism. - 2006. – №7. – p. 15-21.
3.
Dolmans D.E.,
Fukumura D., Jain R.K. Photodynamic therapy for cancer // Nat. Rev.
Cancer. – 2003. – №3. – p. 380-387.