Химия и
химические технологии/ Неорганическая химия
Д.х.н. Скворцов В.Г.*,
к.х.н. Ершов М.А.**, Цыпленкова А.Ю.*,
Егоров Ф.Ф.*
*Чувашский государственный педагогический университет им.
И.Я. Яковлева
(ЧГПУ им. И.Я.
Яковлева), г. Чебоксары, Российская Федерация
**Чувашская государственная сельскохозяйственная академия
(ЧГСХА),
г. Чебоксары, Российская
Федерация
ИНГИБИТОРНЫЕ СВОЙСТВА
БОРАТОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ И АМИНОСПИРТОВ В НЕЙТРАЛЬНЫХ СРЕДАХ
Ранее было показано, что
соли борной кислоты элементов I группы главной
подгруппы периодической системы Д.И. Менделеева и аминоспиртов обладают
ингибирующим действием [1].
Из литературных данных
(с учетом термодинамических расчетов) следует, что в водной среде железо
нестабильно (![]() ) и при стандартных условиях равновесие реакции: Fe +
1/2O2 + H2O
® Fe(OH)2
сильно смещено влево. Можно рассчитать и активность ионов. Так, активность
ионов железа (II)
) и при стандартных условиях равновесие реакции: Fe +
1/2O2 + H2O
® Fe(OH)2
сильно смещено влево. Можно рассчитать и активность ионов. Так, активность
ионов железа (II) ![]() ; гидроксид-ионов
; гидроксид-ионов ![]() . Рассчитана также и величина pH на корродирующей
поверхности: pH»9, а также равновесные
потенциалы водородного и кислородного электродов при данном значении pH
среды:
. Рассчитана также и величина pH на корродирующей
поверхности: pH»9, а также равновесные
потенциалы водородного и кислородного электродов при данном значении pH
среды: ![]() Отсюда видно, что
кислород является более сильным окислителем, чем катионы водорода.
Отсюда видно, что
кислород является более сильным окислителем, чем катионы водорода.
Цель исследования – изучение влияния природы
боратов щелочных металлов (БЩМ), аминоспиртов (АМС), аминоборатных комплексов
(АБК) – на коррозионно-электрохимическое поведение углеродистой стали 10 (Ст.
10) и установление возможности их использования в качестве ингибиторов коррозии
черных металлов и их сплавов от коррозионных разрушений в нейтральных средах.
Исследование проводилось
по методике, описанной в [2]. Для гравиметрических исследований использовали
пластинки из Ст. 10 размером 120´10´1 мм из одной партии,
поэтому ее химический состав, структура и механические свойства были
одинаковыми.
Концентрация растворов
оксоборатов составляла 0,02%. Ингибиторные свойства оценивали по потерям массы
образцов, выдержанных в течение 30 суток в исследуемой среде. Контролем служила
дистиллированная вода (Н2Одист.). Испытания вели в
стационарных условиях при температуре 20оС в трехкратной
повторности. По полученным данным рассчитывали скорость коррозии (r), ингибиторный эффект
(γ) и антикоррозионное действие (Z).
Ингибиторный эффект,
который показывает во сколько раз ингибитор замедляет скорость коррозии,
вычисляли по формуле:
![]() где
ρ и ρ0 – скорость коррозии в
присутствии ингибитора и без него.
где
ρ и ρ0 – скорость коррозии в
присутствии ингибитора и без него.
Скорость коррозии r определяли по убыли
массы образцов, отнесенной к единице поверхности за единицу времени по формуле:
![]() где
m0 и m – масса образцов до и
после опыта, г; S – площадь пластинки, м2; t – время проведения опыта, ч.
где
m0 и m – масса образцов до и
после опыта, г; S – площадь пластинки, м2; t – время проведения опыта, ч.
Степень защиты,
характеризующая полноту подавления коррозии, определяли в %:
![]()
Пересчет одного из этих
параметров в другой проводили соотношением:
![]() и
и 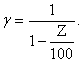
Оценку эффективности
ингибитора осуществляли также по поляризационным кривым, отражающим изменения в
ходе протекания коррозионного процесса в присутствии ингибитора. В этом случае:
![]() и
и
![]() где
i и i0 – ток коррозии в
коррозионной среде с ингибитором и в отсутствии его.
где
i и i0 – ток коррозии в
коррозионной среде с ингибитором и в отсутствии его.
Электрохимические
измерения выполняли на электродах площадью 2.5 см2 в
термостатируемой стеклянной трехэлектродной ячейке. Снятие потенциодинамических
поляризационных кривых осуществляли на потенциостате-гальваностате IPC-Pro
(ИПС) в потенциодинамическом режиме поляризации (V=1.0 мВ/с с платиновым
вспомогательным электродом). Электрод сравнения – хлоридсеребряный.
Исходя из вышеизложенных целей исследований нами
изучено влияние моноэтаноламина H2NCH2OH
(МЭА), диэтаноламина HN(C2H5OH)2
(ДЭА), триэтаноламина N(C2H5OH)3
(ТЭА) и их соединений с ортоборной кислотой: триборатмоноэтаноламин (ТБМЭА), пентаборатдиэтаноламин
(ПБДЭА), пентабораттриэтаноламин (ПБТЭА) на коррозионно-электрохимическое
поведение Ст. 10 в нейтральной среде методами гравиметрии и снятия
потенциодинамических поляризационных кривых. Образование вышеуказанных АБК было
подтверждено методами физико-химического, рентгенофазового,
рентгеноструктурного, термогравиметрического и ИК-спектроскопического анализа.
Измерение значений pH растворов БЩМ показало,
что они обладают буферным действием и при разбавлении концентрация водородных
ионов остается практически неизменной. Следует отметить, что буферное действие
боратов лития и натрия выражено в большей степени, чем у калиевой соли.
Значения pH в исследуемых растворах боратов, найденные
экспериментально, очень близки к расчетной величине в приэлектродном слое
корродирующего металла, причем наибольшей буферной емкостью обладают растворы
тетраборатов.
В воде сталь интенсивно корродирует. Введение
АМС и АБК в коррозионные среды существенно снижает скорость ионизации металла.
При концентрации добавок Cинг£5∙10–3
моль/л ингибирующее действие незначительно. По мере повышения концентрации
защитное действие их возрастает, причем при Cинг³1∙10–2
моль/л наблюдается резкое снижение скорости коррозионного процесса.
Электрохимические исследования указывают на то,
что АМС и АБК при всех исследованных концентрациях не оказывают существенного
влияния на катодную поляризуемость металла и являются ингибиторами
преимущественно анодного действия. При их защитных концентрациях Ст. 10 сразу
переходит в пассивное состояние.
Защитное
действие боратов щелочных металлов заключается не только в увеличении
концентрации гидроксид-ионов, необходимых пассивирующих слоев. Здесь
проявляется также и специфическое действие природы катионов и анионов. Об этом
свидетельствует то, что при одном и том же значении pH и одинаковой молярной
концентрации оксоборатов их влияние на анодное растворение Ст. 10 различно.
В ряду однотипных боратов антикоррозионное
действие уменьшается при переходе от литиевой соли к калиевой. Результаты
эксперимента свидетельствуют о том, что ингибирующее действие боратов в большей
степени зависит от природы их анионов. Специфическое влияние борат-ионов может
найти отражение в способности к адсорбции. На эффект анионов сильное влияние
оказывает их конфигурация. Известно, что наилучшие пространственные условия для
сорбционного процесса на поверхности металла-матрицы у метаборатов, т.к.
образуются плоские полимерные цепи с возможной гексагональной циклизацией. У тетраборатов
образуются в анионе две приблизительно плоские шестиугольные петли, но расположенные
под углом, так что только одна из них может накладываться на поверхность металла,
вторая образует угол с поверхностью. Еще хуже дело обстоит у пентаборат-ионов,
у которых два шестиугольных кольца расположены в плоскостях, образующих двугранный
угол. Отсюда понижение ингибиторной способности в ряду: ![]() >
>![]() >
>![]() .
.
Следует учесть вклад в ингибиторный эффект и катионов.
Заметим, что ингибиторный эффект γ не связан простой зависимостью с
энергией гидратации ΔG. Лучше коррелирует
значениям γ ближняя гидратация, характеризуемая по О.Я. Самойлову
величиной ΔЕ изменения потенциального барьера молекул воды вблизи иона под
его влиянием по сравнению с молекулами воды, окруженными себе подобными. В ряду
катионов Li+, Na+, K+ ΔЕ уменьшается,
т.е. подвижность молекул воды возрастает, причем у катиона калия ΔЕ<0.
По мере увеличения ΔЕ возрастает р-характер 2s-орбитали, что обусловливает
увеличение вклада ковалентной структуры в резонансное состояние частицы,
которая в первом приближении называется ионом. Соответственно понижается вес
ионной структуры и, как следствие, электростатическое взаимодействие с борат-анионом.
В итоге создаются более благоприятные условия для образования оксидно-боратной
пленки.
Из табл. 1 видно, что наибольшее ингибирующее
действие оказывают АМС и АБК по сравнению с БЩМ, причем наименьшие значения
степени защиты Z отмечены у пентаборатов щелочных металлов, а
наибольшие у полиборатов замещенного аммония.
Таблица 1
Влияние концентрациЙ БЩМ,
АМС и АБК на среднюю скорость коррозии (r), коэффициент
торможения (γ) и степень защиты (Z) за 30 сут Ст. 10 в
дистиллированной воде при концентрации Cинг=1∙10-2 моль/л
|
Добавка |
r∙10-3,
г/м2∙ч |
γ |
Z, % |
pH |
|
7.03 |
6.14 |
83.71 |
9.9 |
|
|
Li2B4O7 |
7.80 |
5.53 |
81.92 |
9.2 |
|
LiB5O8 |
7.92 |
5.45 |
81.65 |
8.6 |
|
NaBO2 |
7.43 |
5.81 |
82.78 |
10.2 |
|
Na2B4O7 |
7.89 |
5.47 |
81.71 |
9.2 |
|
NaB5O8 |
8.02 |
5.38 |
81.41 |
8.3 |
|
KBO2 |
9.78 |
4.41 |
77.83 |
11.3 |
|
K2B4O7 |
10.12 |
4.26 |
76.55 |
9.3 |
|
KB5O8 |
8.19 |
5.27 |
69.52 |
8.4 |
|
МЭА |
0.73 |
59.14 |
98.31 |
11.0 |
|
ДЭА |
0.84 |
51.39 |
98.05 |
10.6 |
|
ТЭА |
0.90 |
47.97 |
97.92 |
10.2 |
|
ТБМЭА |
0.62 |
69.63 |
98.56 |
8.8 |
|
ПБДЭА |
0.59 |
73.17 |
98.63 |
8.3 |
|
ПБТЭА |
0.53 |
81.45 |
98.77 |
7.7 |
|
H3BO3 |
52.05 |
0.83 |
-20.57 |
5.6 |
|
H2O (контроль) |
43.15 |
1.00 |
0.00 |
6.6 |
Бораты
щелочных металлов, аминоспиртов и композиций на их основе нашли применение на
практике в качестве смазочно-охлаждающих жидкостей при механической обработке
металлов, ингибиторных и бактерицидных присадок к ним, моющих средств для
очистки деталей от масляно-жировых и других производственных загрязнений, как
стимуляторы роста растений. Они внедрены в производство на предприятиях
Чувашской Республики и за ее пределами.
Литература:
1. Скворцов В.Г.
Аминоборатные комплексы и их применение на практике. /В.Г.Скворцов, М.А.Ершов, О.В.Кольцова, Ю.Ю. Пыльчикова, А.Ю. Леонтьева //
Сб. мат. I Всерос. науч. конф. С Международным участием «Химия и
современность». – Чуваш. гос. пед. ун-т. – Чебоксары: Изд-во ООО «Салика». –
2011. – С. 109-117.
2. Ершов М.А. Тиосемикарбазидо-гидроксиэтилидендифосфоновый
комплекс и его ингибиторные свойства. / М.А.Ершов, Е.В. Камаев, В.Г.Скворцов // Бутлеровские сообщения – 2013. – Т.35. – №9. – С. 14-20.