Медицина/6. Экспериментальная и клиническая фармакология
Политкина С.Н., д.ф.н.
Кондратенко С.Н., д.м.н. Стародубцев А.К.
ГБОУ ВПО Первый
Московский государственный медицинский университет им. И.М. Сеченова, Москва,
Россия
Методика количественного определения
левофлоксацина в слюне методом ВЭЖХ
Левофлоксацин – фторхинолон III
поколения, являющийся оптически активным левовращающим изомером
рацемата офлоксацина, и определяющий
его антибактериальную активность [11].
Поскольку именно левофлоксацин обеспечивает практически все антимикробное
действие в рацемическом препарате, его
активность in vitro в 2
раза выше, чем у офлоксацина [8].
Левофлоксацин характеризуется широким спектром антимикробной активности. Он оказывает воздействие на
многие грамположительные и грамотрицательные аэробные бактерии, внутриклеточные
микроорганизмы и микобактерии. Кроме того, к группе фторхинолонов резистентность развивается реже, чем к
другим классам антибиотиков [3]. Это позволяет использовать препарат при различных заболеваниях,
например пневмонии, инфекции нижних дыхательных путей, туберкулезе, инфекции
мочевыводящих путей, хроническом эндометрите и других [4, 6, 7].
Разными исследователями ранее было установлено,
что многие фторхинолоны хорошо проникают в различные биологические жидкости и
ткани человека, в том числе и в слюну [1,
2, 10]. Однако особенности распределения левофлоксацина в слюне
не изучены. Поэтому представлялось
актуальным разработать методику количественного определения левофлоксацина в слюне пациентов, которую
можно использовать для проведения различных фармакокинеических исследований в
клинической практике.
Для определения концентрации левофлоксацина в слюне выбран метод
обращённофазной высокоэффективной жидкостной хроматографии с УФ-спектрофотометрическим
детектированием. За основу нами была выбрана методика количественного
определения офлоксацина в плазме крови человека Soledad С. Flor с
соавторами [9], которая была нами существенно модифицирована. Количественное
определение левофлоксацина в слюне осуществляли следующим образом.
Реактивы. Субстанция левофлоксацина (ЗАО «Активный компонент»
Россия)
серия 40409, хлороформ для хроматографии ("Химмед", Россия),
ацетонитрил для хроматографии ("Химмед", Россия), метанол для
жидкостной хроматографии ("Labscan",
Ирландия), гексансульфоновый натрий, гидрофосфат натрия, дигидрофосфат натрия
("Sigma", США), кислота ортофосфорная
("Химмед", Россия), вода бидистиллированная. Стандартные растворы
левофлоксацина готовили растворением в метаноле, хранили при 4°С.
Обработка биопроб. К 0,5 мл слюны добавляли 500
мкл фосфатного буферного раствора (рН=7) и 5 мл хлороформа, экстрагировали 10
минут при интенсивном встряхивании в завинчивающихся пробирках. Затем водный и
органический слои разделяли центрифугированием (10 минут при 3000 об/мин).
После чего слюну отбрасывали с помощью «ловушки», а органическую фазу
количественно переносили в коническую колбу и упаривали досуха под вакуумом с
помощью роторного испарителя при температуре 370С. Сухой остаток
растворяли в 300 мкл элюента, перемешивали на Vortex-мешалке 60 секунд. Затем пробу фильтровали через мембранный
фильтр с диаметром пор 0,22 мкм, аликвоту (50 мкл) наносили на колонку
хроматографа.
Хроматографический анализ. Анализ проводили на
высокоэффективном жидкостном хроматографе "Hewlett-Packard" (США) с
УФ-спектрофотометрическим детектором с переменной длиной волны Series 1050 при длине волны 310 нм и аттенюации 4.
Использовалась обращённофазная хроматографическая колонка «Диасорб-130-С16Т», 6
µm, 150x4 mm (АО
«Биохиммак», Россия).
Элюирование проводили мобильной фазой, состоящей из ацетонитрила и
раствора солевого буфера в объёмном соотношении 19:81, доведенной до рН=3
орто-фосфорной кислотой. Солевой буфер готовили растворением в 1 л
бидистиллированной воды 2,68 г дигидрофосфата натрия и 30,8 мг
гексансульфонового натрия.
Полученный элюент перед анализом фильтровали через мембранный
фильтр с диаметром пор 0,22 мкм и дегазировали под вакуумом. Разделение проводили
при комнатной температуре. Скорость элюирования составляла 1 мл/мин, время
удерживания левофлоксацина – 5,9 ± 0,2 мин.
Количественное определение левофлоксацина в слюне
проводили методом абсолютной калибровки. Калибровку проводили следующим
образом. К 0,5 мл слюны, не содержащей препарата, добавляли такие количества
стандартного раствора левофлоксацина, чтобы его концентрация соответствовала
диапазону концентрации в плазме крови пациентов при обычном режиме дозирования
[5, 12]: 0, 0.2, 0.5, 0.7, 1, 2, 3, 5, 6 и 9 мкг/мл. Далее поступали в
соответствии с описанной методикой.
Материалы
и методы.
Для исследования применялся препарат Таваник® – таблетки, покрытые оболочкой, по 500 мг, производства «Санофи
Винтроп Индустрия», Франция. Серия препарата 0H14F,
срок годности до 01.2016.
Распределение
левофлоксацина в слюне изучалось у здорового добровольца-мужчины (возраст 21 года, рост 180 см, вес 71 кг)
после однократного приема внутрь натощак препарата Таваник® в дозе 500 мг. Стандартный завтрак разрешался через 3 часа после приема препарата. После приема
препарата, приемов пищи и напитков доброволец тщательно прополаскивал рот
водой.
Отбор проб слюны
осуществлялся без стимуляции слюноотделения в
пластиковые пробирки в количестве 2–3 мл до и через 0.25, 0.5, 1.0,
1.5, 2.0, 2.5, 3.0, 4.0, 5.0, 8.0, 10.0, 12.0 и 24.0 часа после приема
препарата.
Результаты и
обсуждение. Описанная
методика позволяет количественно определять уровень левофлоксацина в
слюне человека. На рис. 1 представлены хроматограммы стандартного раствора
левофлоксацина, проб слюны до приема и через 1,5 часа после приема препарата Таваник® в дозе 500 мг, а калибровочная зависимость между значениями площади хроматографических пиков левофлоксацина и
его концентрацией в слюне представлена на рис. 2.
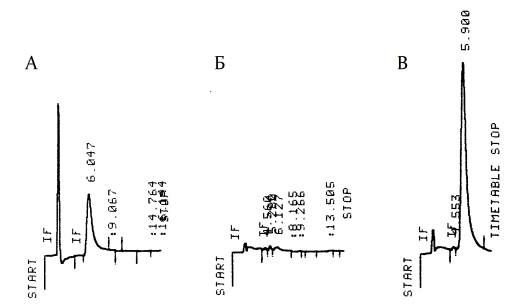
Рис.1 Хроматограммы стандартного раствора левофлоксацина (А), проб слюны
здорового добровольца до приема (Б) и
через 1,5 часа после приема (В) препарата Таваник®.
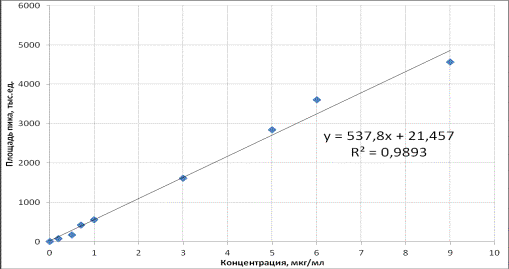
Рис. 2. Калибровочный график
зависимости площади пика левофлоксацина
от его содержания в слюне.
Время удерживания в приведенных условиях
хроматографирования составляло 5,9 ± 0,2
мин. Предел обнаружения составил 0,1 мкг/мл слюны. Калибровочная зависимость площади хроматографических
пиков левофлоксацина от его содержания в слюне в указанном диапазоне
концентрации была линейной, коэффициент корреляции r2 =
0,9893, уравнение регрессии имело вид:
у = 21,457 + 537,8·х,
где х –
концентрация левофлоксацина в слюне (мкг/мл);
у – площадь хроматографического пика левофлоксацина.
Поскольку при
хроматографировании в образцах слюны кроме пика левофлоксацина значимых пиков
эндогенных веществ, способных исказить результаты анализа, не выявлено, можно говорить
об оптимальном выборе экстрагента и селективности предложенной методики.
С помощью разработанной
методики была исследована динамика распределения левофлоксацина в слюне здорового добровольца после приема
препарата Таваник®, которая представлена на рис. 3.
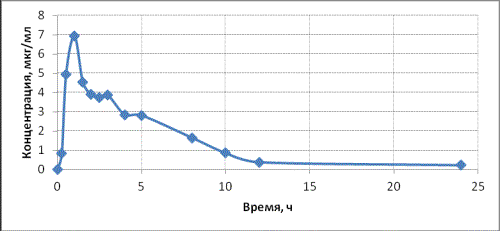
Рис. 3. Динамика концентрации левофлоксацина в слюне здорового
добровольца после однократного приема препарата Таваник® в дозе 500 мг.
Как следует из приведенных данных,
чувствительность методики достаточна
для того, чтобы проследить уровень
левофлоксацина в течение 24 часа после
приема препарата. Уже через 15 минут после приема в слюне регистрируется левофлоксацин в количестве
0,832 мкг/мл. Затем концентрация левофлоксацина в слюне быстро возрастает, максимальная
уровень наблюдается через 1 час после приема и составляет 6,948 мкг/мл. После
чего наблюдается постепенное снижение концентрации левофлоксацина в слюне и
через 24 часа его уровень составляет 0,219 мкг/мл.
Таким образом, представленная
методика количественного определения левофлоксацина в слюне методом ВЭЖХ
является специфичной, чувствительной и
может быть использована для оценки уровня
левофлоксацина в слюне пациентов в ходе клинических фармакокинетических
исследований.
Литература:
1.
Глущенко
И.А., Кондратенко С.Н., Стародубцев А.К. Сравнительная фармакокинетика
фторхинолонов и особенности их распределения в слюне. // Клиническая
фармакология и терапия. 2011. Т. 20, № 2. С. 53–58.
2.
Золкина
И.В., Кондратенко С.Н., Кабанова И.А., Стародубцев А.К. Сравнительная
фармакокинетика препаратов моксифлоксацина по динамике его распределения в
плазме крови и слюне. // Фармация. 2007. № 8. С. 30–33.
3.
Козлов С.Н.,
Страчунский Л.С. Современная
антимикробная химиотерапия. 2-е
изд. М.: МИА, 2009. 448 С.
4.
Макаров
И.О., Шешукова Н.А. Возможности применения фторхинолонов в комплексном лечении хронического эндометрита.
// Трудный пациент. 2012. Т. 10, № 2-3. С. 12-15.
5.
Падейская
Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолонов в клинической
практике. Гл. 9. М: Логата, 1998. – 351 с.
6.
Шпрыков А.С., Писарев В.В.
Левофлоксацин в терапии бактериальных заболеваний легких: новое в фармакокинетике препарата у многокурящих
больных. // Современные технологии в
медицине. 2011. № 1. С. 105-107.
7. Козлов
С.Н., Козлова Т.Д. Таваник (левофлоксацин) в лечении инфекций мочевыводящих
путей. // Русский медицинский журнал.
2010. Т. 18. № 25. С.
1515-1520.
8. Anderson
V.R., Perry C.M. Levofloxacin: a review
of it’s a high-dose, short-course treatment for bacterial infection. // Drugs.
2008. V. 68, N 4. P. 535–565.
9. Flor S.C., Rogge M.C., Chow A.T. Bioequivalence of oral and intravenous
ofloxacin after multiple-dose administration to healthy male volunteers. //
Antimicrobial Agents and Chemotherapy, 1993, vol. 37, N 7, p. 1468–1472.
10. Kozjek F., Šuturcova L.J., Antolič
G. et al. Kinetics of 4-fluoroquinolones permeation into saliva. //
Biopharmaceutical and Drug Disposition. 1999. V. 20. P. 183–191.
11. Mollering B.C. Overview of newer quinolones.
Levofloxacin. Symp 19 th Intern Congr Chemother. Montreal, 1995. P.45-58.
12. Product Monograph
Levavin (levofloxacin). Antimicrobial Agent. Control №:105554. Janssen-Ortho
Inc., 2006, p. 44–46.