Медицина/7.Клиническая медицина
К.м.н. Аниконова Л.И., Акамёлкова С.Н., к.м.н. Колмакова Е.В., д.м.н. Вавилова Т.В.
Северо-Западный
государственный медицинский университет имени И.И. Мечникова, Россия
Цистатин С как ранний
биомаркер контраст-индуцированного острого почечного повреждения
Острое почечное
повреждение (ОПП) является существенной проблемой клинической медицины. ОПП
нередко встречается в различных популяциях пациентов, включая больных отделений
интенсивной терапии (ОИТ), кардиохирургии, отделений, где проводится
ангиография с использованием рентгеноконтрастных препаратов. Последствиями ОПП являются увеличение продолжительности
госпитализации, потребность в почечной заместительной терапии (ПЗТ), развитие
хронической болезни почек (ХБП), увеличение смертности [1-3].
В настоящее
время сывороточный креатинин (sCr) и
диурез – стандартные индикаторы появления ОПП, хотя их недостатки известны. Они
имеют ограниченную чувствительность и специфичность; изменения sCr с
опозданием реагируют на почечное повреждение. Так, повышение sCr после воздействия повреждающего фактора начинается
после 24 часов [4], что снижает его
ценность для диагноза ОПП и диктует потребность в новых, более ранних маркерах
ОПП.
Альтернативой sCr, как эндогенному маркеру
скорости клубочковой фильтрации (СКФ), является сывороточный цистатин С (sСysС). Как известно, sСysС в 2004 году официально одобрен FDA (США) как маркер для альтернативного определения СКФ
при ХБП. Сравнительно недавно
исследователи сфокусировались на использовании sСysС для ранней диагностики
ОПП, но при этом оценка sСysС как предиктора ОПП
варьирует в разных исследованиях [5-8].
В клинической практике sСysС, как маркер СКФ, применяется, по-прежнему, редко, в том числе в
отделениях интервенционной кардиологии, где высок риск развития рентгеноконтрастных
нефропатий.
Целью работы была оценка в проспективном
исследовании предикативной ценности sСysС в диагностике контраст-индуцированной
ОПП (КИ-ОПП). Пациенты и методы. В исследование включались пациенты,
поступавшие в отделении интервенционной кардиологии в период с 12.2010 по
06.2011 года для проведения коронарной ангиографии (КАГ) и/или баллонной ангиопластики
со стентированием, и имеющие средний/высокий риск развития КИ-ОПП [9]. Были исключены
пациенты с дисфункцией щитовидной железы, системным воспалением, получающие
кортикостероиды. Всего отобрано 68 пациентов, из которых мужчин было 64; их
средний возраст (M±SD) составил 65,2±6,3 года.
Клиническая характеристика пациентов представлена в табл. 1. Коронарная ангиография выполнялась с использованием
неионного изоосмолярного рентгеноконтрастного препарата йодиксанола (визипак).
sСysС и sCr определяли накануне интервенции и через 18-20 ч
после введения рентгеноконтрастного препарата; определение sCr повторяли
через 48 и 72 ч. Профилактика контраст-индуцированной ОПП проводилась согласно
существующим рекомендациям [10, 11]. Рутинно в день коронарного вмешательства
отменялись диуретики, НПВП, метформин. Пациенты не получали N-ацетилцистеин
ввиду его способности занижать показатель sCr вне связи с функцией почек.
До исследования образцы сыворотки хранились при температуре - 20°С.
Исследование sСysС
проводилось иммунотурбидиметрическим методом наборами компании Alfresa
(Япония) на биохимическом анализаторе KONELAB-20.
Измеряемые концентрации СysС находятся в интервале
0,2-8,0 мг/л. Референтный интервал составляет 0,63-0,95 мг/л [12]. ОПП
диагностировали согласно критериям AKIN [13].
Диагностическую
ценность разной степени повышения sСysС для ранней диагностики
ОПП оценивали по таким показателям, как
чувствительность, специфичность, вид ROC кривой (Receiver Operating Characteristic Curve) и
площадь под кривой ROC - AUROC (Area Under ROC) [14]. Для анализа вероятности наступления ОПП в зависимости от повышения sСysС использовался
метод бинарной логистической регрессии. В качестве контрольной группы
принимались те пациенты, у которых ОПП не развилась, а основной – группа, в которой
диагностирована ОПП. Для статистических расчетов использовали пакет SPSS
(версия 13).
Таблица 1. Характеристика пациентов (N=68)
|
Возраст, годы (M±SD) Мужчины/женщины Гемоглобин, г/л (M±SD) Креатинин сыворотки исходный, ммоль/л (M±SD) СКФ, мл/мин/ (MDRD), Хроническая болезнь почек II стадии, % Хроническая болезнь почек III стадии, % Сахарный диабет, % Хроническая сердечная недостаточность, классы 1-2/3
(NYHA), % |
65,2±6,3 64/4 139,9±16,5 0,113±0,009 61,2±7,1 55,9 44,1 17,6 96/4 10,3 |
Полученные результаты. КИ-ОПП была диагностирована через 48 ч после чрезкожного коронарного
вмешательства с использованием рентгеноконтрастных препаратов у 11 из 68 человек. Эти показатели выше тех,
что мы получили в предыдущем исследовании [9], в котором из 557
пациентов, перенесших КАГ и/или баллонную ангиопластику, КИ-ОПП развилась у 8,4% пациентов.
Этот факт мы связываем с высокой коморбидностью пациентов в настоящем
исследовании из-за целенаправленного их подбора. Диагноз ОПП основывался у 3 пациентов
на повышении sCr в 1,5-2 раза, у 7 человек – на повышении sCr
≥0,026 ммоль/л, по сравнению с исходным, что соответствовало 1 стадии ОПП,
и у 1-го пациента – повышении sCr в 2,1 раза (II стадия
ОПП). Более значительного повышения sCr не отмечено.
Через 18 часов после
введения рентгеноконтраста ни у одного пациента по существующим критериям не диагностировано
ОПП. Повышение sCysC в 1,1-2,09
раз в этот же период отмечено у 30 человек. Средние значения sCr и sCysC в динамике
представлены в таблице 2; изменения
были статистически не значимы.
Таблица 2. Показатели
сывороточного креатинина (sCr) и сывороточного цистатина С (sСysС) до и после введения
рентгеноконтрастного препарата у пациентов с развившейся ОПП
|
sCr (ммол/л) |
sСysС (мг/л) |
|||
|
Исходный |
18 ч |
48 ч |
Исходный |
Через 18 ч |
|
0,113±0,009 |
0,113±0,011 |
0,120±0,023 |
1,22±0,60 |
1,33±0,77 |
Используя метод
бинарной логистической регрессии, оценивали информативные характеристики разных
порогов превышения СysС, по сравнению с исходным уровнем, с пошаговым
определением в 10% для выбора оптимальной отсечной точки (cut off).
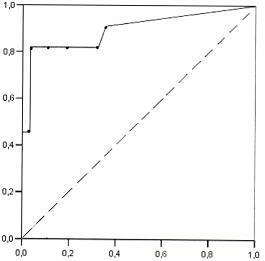
Оптимальное
соотношение чувствительности и специфичности (81,8% и 98,2% соответственно) динамичного
определения уровня sСysС было получено при его повышении
на 50% и более. В этом случае площадь под кривой – AUROC составила 0,90 (95% CI
0,76-1,03), максимально приближаясь к 1,0. ROC -кривая представлена на
рис.1.
Предсказательная
ценность повышения уровня sCysC на
50% и более, по сравнению с исходным, в указанные сроки наблюдения составила 90%,
в то время как превышение на 10% и более, 20% и более или 40% не имело столь
выраженного положительного прогностического значения (33,3%, 36% и 56,3% соответственно)
в развитии КИ-ОПП. AUROC при 20% и 10% повышением концентрации sСysС, по
сравнению с исходной, составила 0,79 и 0,78 соответственно (95% CI
0,65-0,91).
Рис.1. ROC -кривая с графическим представлением
соотношений чувствительности-специфичности для разных порогов повышения sСysС через 18-20 ч после введения контраста.
![]()
![]()
1- с п е ц и ф и ч н о с т ь
Выводы.
SСysС – чувствительный и более ранний, по сравнению с sCr, эндогенный
маркер СКФ, позволяющий в течение 18-20 ч после введения рентгеноконтрастного препарата
диагностировать КИ-ОПП. Полученные данные имеют существенное значение для
пациентов, имеющих риск развития КИ-ОПП после коронарной ангиографии с
применением рентгеноконтрастных средств. Определение sСysС может быть выполнено в условиях стандартной клинической лаборатории, на
биохимическом анализаторе, а время определения СysС в сыворотке крови составляет несколько минут. Для диагностики ОПП нужны
комбинированные панели биомаркеров, и в этом аспекте СysС наиболее ранний
и доступный эндогенный маркер
падения СКФ.
Литература:
1. Сhertow
GM BE, Honour M, Bonventre JV, et al. Acute kidney injury, mortality, length of stay, and
costs in hospitalized patients. JASN
2005; 16: 3365-3370
2. Waikar SS, Liu KD
and Chertow GM. Diagnosis, epidemiology and outcomes of acute kidney injury. Clin J Am Soc Nephrol 2008; 3:844-861
3. McCullough PA,
Wolyn R, Rocher LL et al. Acute renal failure after coronary intervention:
incidence, risk factors, and relation to mortality. Am J Med 1997; 103: 368-375
4. Kassirer JP.
Clinical evaluation of kidney function – glomerular function. N Engl J Med 1971; 285: 385-389
5.
Briguori C, Visconti G, Rivera NV, et al. Cystatin C and contrast-induced
acute kidney injury. Circulation. 2010;121 (19): 2117-2122
6. Herget-Rosenthal S,
Marggraf G, Husing J et al. Early detection of acute renal failure by serum
cystatin C. Kidney int 2004;
66:1115-1122
7.
Nejat M, Pickering J, Walker R and Endre Z. Rapid detection of acute
kidney injury by plasma cystatin C in the intensive care unit. Nephrol Dial Transplant 2010, 25: 3283–3289
8. Zhang Z, Lu B, Sheng X, and Jin N. Cystatin
C in Prediction of Acute Kidney Injury: A Systemic Review and Meta-analysis. Am J Kidney Dis.2011;58 (3): 356-365
9. Аниконова Л.И., Болдуева С.А. Контраст-индуцированная
нефропатия. В: Радченко ВГ, ред. Актуальные
вопросы внутренних болезней. ГОУВПО СПбГМА им. И.И. Мечникова Росздрава, СПб.; 2010; 10-15
10. Lameire N, Van Biesen W, Hoste
E and Vanholder R. The prevention of acute kidney injury in depth narrative
review: Part 2. NDT Plus 2009; 1:
1-10
11.
Практические
рекомендации KDIGO 2012: сокращенный перевод с
англ. – СПб: ООО Ай-Пи, 2012: с.7-4910
12.
Тишко А.Н. Цистатин С и
его значение в диагностике поражения почек у больных с длительно текущим
ревматоидным артритом. Медико-биологические
и социально-психологические проблемы безопасности в чрезвычайных ситуациях 2010; (1): 74-79
13. Mehta RL, Kellum JA, Shah S, et al. Acute
Kidney
Injury Network: Report of an initiative to improve outcomes in acute kidney
injury. Crit Care 2007; 11:R31
14. Coca SG, Yalavarthy R, Concato
J and Parikh CR. Biomarkers for the diagnosis and risk stratification of acute
kidney injury: A systematic review.
Kidney int 2008; 73: 1008-1016