Химия и химические технологии / 5.
к.т.н. Родионов И.В.
Саратовский государственный технический
университет
О возможности создания оксидных биосовместимых
покрытий на титановых имплантатах методом
паротермического оксидирования
Медицинские костные имплантаты представляют биотехнические изделия, предназначенные для хирургического лечения различных костных патологий опорно-двигательного аппарата и челюстно-лицевой области. Наибольшее значение при этом имеют биологическая совместимость имплантата с окружающей биосредой, а также его механическая совместимость с функциональными нагрузками. Необходимым уровнем указанных свойств обладает ограниченное число материалов, из которых чаще других используются биоинертные технический титан ВТ1-00 и титановый сплав ВТ16, имеющие наиболее благоприятное сочетание биомеханических характеристик. Для медицинских костных имплантатов, широко используемых в травматологии, ортопедии, стоматологии, биосовместимость должна проявляться как биоактивность поверхности, характеризуемая способностью к интеграции с окружающей биотканью. Биоактивными качествами отличаются биокерамические материалы, которые наносятся на титановую основу имплантата в виде покрытий за счет применения различных технологических методов. Такие биопокрытия создаются из гидроксиапатита, трикальцийфосфата, биостекла, углеродных материалов, специально сформированных металлооксидов. При этом между покрытием и биоструктурами происходит биофизикохимическое и механическое взаимодействие, обусловливающее интеграцию покрытия с окружающей костной тканью за счет прорастания костных клеток в углубления, а также поры микрорельефа поверхности. В результате такого взаимодействия костного имплантата может создаваться прочная биотехническая система «имплантат – окружающая ткань» с высокой эффективностью функционирования.
Наиболее простой технологией получения покрытия с качествами биоактивности
является оксидирование титановых имплантатов, в результате которого на
поверхности образуется оксидный слой со структурой, способной к проявлению
биоактивности [1, 2].
Для формирования качеств биоактивности оксидных покрытий большое
значение имеют показатели их фазового состава, толщины, шероховатости и
морфологической гетерогенности поверхности, а также уровень коррозионной
стойкости оксидированных имплантатов. Комплекс указанных характеристик,
необходимый для эффективного приживления костных титановых имплантатов в
организме создается за счет применения определенных технологических режимов
паротермического оксидирования. К таким режимам относятся температура и
продолжительность обработки, показатели которых существенным образом влияют на
физико-химические и механические свойства получаемых оксидных покрытий, а также
качества их биосовместимости.
Исследование паротермического оксидирования титановых имплантатов,
предварительно обработанных пескоструйным способом, при температурах 450 и 5500С
с продолжительностью 1, 2, 3 ч показало, что в данных технологических условиях
создаются покрытия с высокооднородным фазовым составом, включающем, в основном,
биоинертный диоксид TiO2 с наличием весьма малого содержания низших
оксидов Ti2O3 и Ti3O5. Формирование только титанооксидного
состава покрытий без чужеродных
соединений и примесных фаз, оказывающих негативное влияние на функциональные
свойства поверхности имплантатов, свидетельствует о том, что принятые режимы
паротермического оксидирования обеспечивают получение преимущественно
однофазного титанооксидного покрытия с
однородным структурным состоянием и свойствами.
Оптико-микроскопическое измерение толщины h покрытий на микрошлифах
плоских оксидированных образцов-свидетелей и сравнительная оценка ее значений в
зависимости от режима обработки показали, что при t = 4500С и τ
= 1, 2, 3 ч толщина увеличивается в пределах 4-6 мкм через каждый час окисления
и составляет величину порядка h = 20 мкм при наибольшей
продолжительности, равной τ = 3 ч. Таким
образом, относительно невысокая температура оксидирования титана в
окислительной атмосфере с недостатком кислорода не обеспечивает активного
образования оксидов и интенсивного роста покрытия в толщину даже при
значительной продолжительности паротермической обработки.
Возрастание температуры до 5500С
существенно ускоряет протекание физико-химических реакций и скорость процесса
окисления титановой поверхности с формированием толщины покрытия на уровне h =
25 мкм – при τ = 1 ч, h = 34 мкм – при τ = 2
ч, h = 45 мкм – при τ = 3 ч. Данные значения толщины покрытий являются
более благоприятными для обеспечения требуемых условий механической
совместимости оксидированных имплантатов с костной тканью и их эффективного
функционирования.
Таким образом, температура 5500С,
продолжительность 2 и 3 ч способствуют созданию покрытия костных имплантатов с
необходимой для их нормального биомеханического взаимодействия толщиной, что
характеризует эффективность применения паротермического оксидирования при
выбранных режимах.
Профилометрическое измерение шероховатости
исходной, пескоструйно-обработанной поверхности титановых имплантатов показало,
что величина параметров профиля соответствует значениям Rа = 0,84 мкм, Rz
= 2,80 мкм, Rmax
= 4,00 мкм, Rр = 2,10 мкм и Sm = 8,30 мкм
(табл. 1). В процессе последующего паротермического оксидирования такой
поверхности при температуре t =
4500С и продолжительности τ = 1 ч происходит некоторое
повышение шероховатости с увеличением параметров высоты Rа, Rz,
Rmax, Rр и небольшим уменьшением величины
шага неровностей Sm. При τ = 2 ч значения параметров Rа,
Rz, Rmax, Rр несколько
снижаются, шаг местных выступов Sm увеличивается, что обусловлено
преимущественным окислением донных частей микровпадин и общим сглаживанием
профиля покрытия. При τ = 3 ч происходит некоторое возрастание толщины
покрытия, что приводит к образованию в нем повышенного количества различных
микронеровностей и соответствующему увеличению уровня шероховатости (табл. 1).
Таблица 1
Параметры шероховатости
титанооксидного покрытия, полученного
паротермическим
оксидированием имплантатов при t = 4500С и
различной
продолжительности
|
Продолжительность оксидирования τ, ч |
Параметры шероховатости, мкм |
||||
|
Ra |
Rz |
Rmax |
Rp |
Sm |
|
|
Исходная пов-сть |
0,84 |
2,80 |
4,00 |
2,10 |
8,30 |
|
1 |
0,96 |
3,10 |
4,63 |
2,33 |
7,50 |
|
2 |
0,94 |
2,90 |
4,44 |
2,21 |
10,30 |
|
3 |
1,16 |
3,13 |
5,23 |
2,74 |
11,00 |
Подобная кинетика изменения параметров
микрорельефа оксидного покрытия характерна и для оксидирования имплантатов при
значениях t = 5500С, τ = 1, 2, 3 ч (табл. 2). Так, при τ = 1 ч шероховатость покрытия
возрастает по сравнению с исходной пескоструйно-обработанной поверхностью,
при τ = 2 ч она практически не изменяется, а при τ = 3 ч
шероховатость значительно увеличивается.
Таблица 2
Параметры шероховатости титанооксидного покрытия, полученного
паротермическим оксидированием
имплантатов при t = 5500С и
различной продолжительности
|
Продолжительность оксидирования τ, ч |
Параметры шероховатости, мкм |
||||
|
Ra |
Rz |
Rmax |
Rp |
Sm |
|
|
Исходная пов-сть |
0,84 |
2,80 |
4,00 |
2,10 |
8,30 |
|
1 |
1,01 |
3,30 |
5,00 |
2,12 |
8,11 |
|
2 |
1,07 |
3,20 |
5,07 |
2,32 |
10,00 |
|
3 |
1,20 |
3,62 |
5,56 |
2,50 |
12,00 |
Анализ и оценка результатов исследования показывают, что наибольшие
значения параметров шероховатости титанооксидного покрытия обеспечиваются при
повышенной продолжительности оксидирования имплантатов, способствующей росту
толщины покрытия и развитию микрорельефа поверхности.
По приведенным основаниям следует считать, что
необходимый для создания высокой биоинтеграционной способности имплантатов
микрорельеф получается в процессе формирования оксидного покрытия при t=5500С и τ=3 ч.
Исследование структурных элементов оксидированной поверхности показало,
что формирование парооксидных покрытий на титане существенно зависит от
температуры и продолжительности оксидирования. Так, при температурах 450 и 5500С
повышение продолжительности оксидирования от 1 до 2 ч создает значительное
увеличение радиуса частиц при снижении радиуса пор и величины пористости.
Оксидирование в течение 3 ч при тех же температурах приводит к некоторому
уменьшению радиуса частиц, вызывает рост радиуса пор и открытой пористости
(рис.).
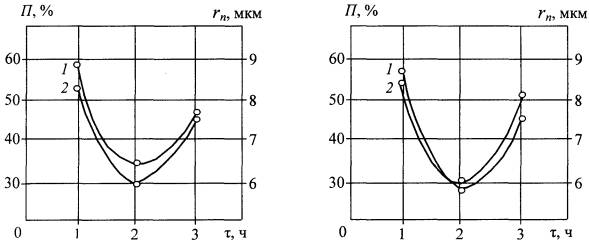
t = 4500С t =
5500С
Рис. Влияние
режима паротермического оксидирования на изменение открытой пористости и
радиуса пор титанооксидного покрытия:
кривая 1 – изменение пористости, кривая 2 – изменение радиуса пор
Анализ полученных результатов позволяет считать, что рост продолжительности оксидирования от 1 до 2 ч создает более интенсивное окисление микровпадин, чем снижает размер пор. За счет этого увеличивается площадь поверхности между порами, происходит сглаживание микрорельефа и повышается структурно-морфологическая однородность титанооксидного покрытия. Оксидирование в течение 3 ч при тех же температурах значительно повышает толщину покрытия с появлением внутренних напряжений, превышающих предел его прочности. Из-за этого в покрытии образуются микротрещины с формированием крупных пор и увеличением морфологической гетерогенности. Это придает титанооксидному покрытию качества биоактивности и улучшает его остеоинтеграционные способности.
Необходимая для нормального биомеханического
взаимодействия покрытия с костной тканью морфология образуется в процессе
паротермического оксидирования титана при температуре 5500С и
продолжительности 3 ч. За счет этого указанный режим может создать наиболее
благоприятные условия для получения титанооксидного покрытия костных
имплантатов с биоинтеграционными качествами поверхности и высокой эффективностью
их функционирования.
Коррозионное поведение
имплантатов с оксидными покрытиями в физиологическом растворе, моделирующем
состав плазмы крови и тканевой жидкости организма, характеризуется положительными
значениями их электродных потенциалов Ес при всех принятых режимах оксидирования
(табл. 3). Это указывает на термодинамическую устойчивость покрытий и их
высокую сопротивляемость коррозии.
Таблица 3
Коррозионные потенциалы парооксидных покрытий титана,
полученных при различных режимах оксидирования
|
Температура паротермического оксидирования t, 0С |
Продолжительность оксидирования τ, ч |
t, 0С модельного раствора |
||||
|
25 |
30 |
35 |
40 |
45 |
||
|
Ес покрытия, мВ (н.х.с.э) |
||||||
|
450 |
1 |
109 |
106 |
103 |
104 |
113 |
|
2 |
108 |
111 |
110 |
124 |
121 |
|
|
3 |
130 |
136 |
134 |
121 |
122 |
|
|
550 |
1 |
118 |
133 |
136 |
133 |
130 |
|
2 |
313 |
268 |
250 |
189 |
178 |
|
|
3 |
57 |
65 |
65 |
62 |
62 |
|
Данные результаты показывают
сильную зависимость коррозионного потенциала титанооксидного покрытия от режима
паротермического оксидирования, при этом наибольшее влияние оказывает
температура оксидирования. Материалы ранее проведенных коррозионных испытаний
позволяют считать, что главную роль в полученной зависимости играет изменение
фазово-структурного состояния покрытия, в первую очередь, морфологическая гетерогенность
поверхности и степень ее пористости [3, 4].
Согласно имеющимся данным с
увеличением показателей микрошероховатости, уменьшением размера частиц
макрорельефа и повышением пористости поверхности возрастает физическая площадь
ее контакта с модельным раствором, увеличивается электрохимическая
гетерогенность. При этом донная часть возникающих трещин, пор, углублений
отличается более отрицательным потенциалом по сравнению с их стенками. В
указанных условиях термодинамическая устойчивость поверхности снижается при
уменьшении ее коррозионного потенциала и повышении склонности к коррозии.
При температуре оксидирования 4500С
в течение 1 и 2 ч невысокая скорость реакционной диффузии атомов титана и
кислорода создает небольшое различие в размерах морфологических частиц, пор и
степени пористости получаемых покрытий, что сближает значения их потенциалов
(табл. 3). Повышение продолжительности оксидирования до 3 ч заметно увеличивает
толщину покрытия и сглаживает макрорельеф поверхности, повышая ее склонность к
пассивации и величину электродного потенциала.
При температуре 5500С
и продолжительности 2 ч размер макрочастиц на поверхности покрытия значительно
повышается, а пористость уменьшается, что увеличивает термодинамическую
устойчивость и значение электродного потенциала. Сильное падение потенциала при
увеличении нагрева модельного раствора может быть связано с ростом активности
его ионов, для продвижения которых вглубь данная структура оказывает наименьшее
сопротивление.
Увеличение продолжительности оксидирования
до 3 ч создает повышенную толщину покрытия с возрастанием его внутренних
напряжений. Это вызывает значительный рост размера трещин, пор и степени
пористости, снижая величину потенциала поверхности от 0,240 В до 0,064 В при
температуре раствора, соответствующей норме для организма. Данное снижение
потенциала свидетельствует об уменьшение электрохимического сопротивления покрытия
протеканию коррозионных процессов.
Полученные результаты исследования и их анализ
позволяют рекомендовать применение паротермического оксидирования при
температуре 5500С в течение 2 ч для получения однофазного,
структурно гетерогенного парооксидного биопокрытия на костных стоматологических
имплантатах длительного функционирования с наилучшим уровнем коррозионной
стойкости при взаимодействии с окружающей биосредой. Для чрескостных ортопедических
и других временных имплантатов более целесообразным является режим оксидирования
при температуре 5500С и продолжительности 3 ч за счет чего создается
структурное состояние покрытия с увеличенной пористостью и высоким уровнем
шероховатости, обеспечивающих формирование повышенных качеств биоактивности.
На основании сопоставления полученных результатов экспериментальных исследований можно заключить, что паротермическое оксидирование пескоструйно-обработанного титана при t=4500С, τ=3 ч и t=5500С, τ=1, 2, 3 ч создает такие условия формирования титанооксидных покрытий, при которых они приобретают физико-химические, механические и поверхностно-структурные характеристики, благоприятствующие необходимому биоактивному взаимодействию оксидированного титанового имплантата с окружающей костной тканью. Указанные режимы оксидирования могут применяться для получения биоинтеграционных покрытий как на стоматологических внутрикостных титановых имплантатах постоянного функционирования, так и на чрескостных спицевых, а также стержневых остеофиксаторах с временным характером их функций в организме.
Технология паротермического оксидирования титановых имплантатов
представляется особенно перспективной вследствие получения оксидных биопокрытий
с высокой однородностью фазового состава, а значит физико-химических и
механических свойств поверхностных оксидов, что является благоприятным при
взаимодействии парооксидированных имплантатов как с костными, так и жидкими биоструктурами.
Высокий уровень коррозионно-электрохимической стойкости таких покрытий
обусловливает надежность приживления и эффективность функционирования костных
имплантатов, а также характеризует их повышенную биосовместимость. Кроме того,
путем изменения основных технологических режимов оксидирования – температуры и
продолжительности обработки, можно в широком диапазоне варьировать важнейшие
показатели функциональных характеристик парооксидных биопокрытий, не применяя
при этом дополнительных воздействий.
Литература
1. Патент РФ на изобретение № 2322267. Способ получения биосовместимого покрытия на имплантатах из титана и его сплавов / Родионов И.В., Бутовский К.Г., Бейдик О.В., Серянов Ю.В. Опубл. 20.04.2008.
2. Патент РФ на изобретение № 2332239. Способ получения биосовместимого покрытия на остеофиксаторах из титана / Родионов И.В., Бутовский К.Г., Бейдик О.В., Ткачева А.В. Опубл. 27.08.2008.
3. Вильямс Д.Ф., Роуф Р. Имплантаты в хирургии. Пер. с англ. М.: Медицина, 1978. – 552 с.
4. Родионов И.В., Бутовский К.Г. Электрохимическое моделирование
коррозионного поведения костных имплантатов с покрытиями при воздействии
биосреды // Биомедицинская радиоэлектроника. №1-2, 2008. С. 87-98.