Биологические науки/9.Биохимия и
биофизика
Пшеничная Э. Н., к.б.н.
Воробьева О. В., Ковалькова М. В.
Ставропольский
Государственный университет, Россия
ПОЛУЧЕНИЕ
ВЫСОКОЭФФЕКТИВНЫХ ПРЕПАРАТОВ
β-ГАЛАКТОЗИДАЗЫ
Разработка иммобилизованных
биокатализаторов способствует получению устойчивых препаратов многоразового
использования. В пищевой промышленности одной из актуальных остается проблема
создания безлактозных и низколактозных пищевых продуктов. Установлено, что
около десяти процентов населения страдает галактоземией, которая обусловлена
отсутствием в организме фермента β-галактозидазы, участвующего в каталитическом
расщеплении дисахарида лактозы на моносахара галактозу и глюкозу, что приводит
к различным нарушениям в работе желудочно-кишечного тракта [1,2,3]. Для успешной
профилактики и лечения этого заболевания необходимо исключить поступление
лактозы в организм с пищей. Химический гидролиз лактозы, содержащейся в
молочном сырье, требует больших затрат для очистки получаемых продуктов,
поэтому одноступенчатый процесс, основанный на использовании иммобилизованной
β-галактозидазы позволит эффективно решить данную проблему.
Целью данной работы было
получение иммобилизованных препаратов β-галактозидазы с высоким процентом
сохранения активности.
Для иммобилизации β-галактозидазы
использовали фермент с активностью 14,6 ммоль/г фермента.
Активность
ß-галактозидазы определяли по методу предложенному А.К. Куликовой, где в
качестве субстрата использовалась лактоза [4]. Содержание глюкозы в растворе определяли
колориметрическим методом, измеряя оптическую плотность пробы и эталона при
длине волны 480¸520 нм на биохимическом анализаторе BTS-310.
Каталитическую активность
растворимого и иммобилизованного фермента рассчитывали по формуле
![]() ,
,
где К0 – количество глюкозы в опытном
образце, мкмоль; Кк - количество глюкозы в контрольном образце, мкмоль; А –
количество фермента, взятого в реакцию, мг; t – время реакции, мин.
Для иммобилизации фермента были
использованы сорбенты, полученные методом формирования пористой структуры
кремнийорганической матрицы в присутствии непористого кремнезема аэросила и
органических компонентов синтеза: полисахаридного полимера декстрана и γ– аминопропилтриэтоксисилана
(АГМ-9). Процесс и схемы получения декстранокремнеземного и аминокремнеземного сорбентов
изложены в работах [5,6].
Иммобилизацию фермента b-галактозидазы проводили следующим образом: к
4 г влажного сорбента приливали 10 мл раствора b-галактозидазы с концентрацией 5,5-5,7 мг/мл,
инкубацию проводили в течение 48 часов при температуре +4°С. Несвязавшуюся с носителем b-галактозидазу удаляли
промыванием матрицы дистиллированной водой до получения отрицательной пробы на
присутствие белка по методу Лоури [7]. Иммобилизованный
препарат хранили при температуре + 4°С.
Характеристика иммобилизованного фермента представлена в таблице 1.
Таблица 1 – Характеристика иммобилизованных препаратов
b-галактозидазы
|
Носитель |
Удельная активность фермента, ммоль/г фермента |
Сохранение
активности иммобилизованного фермента, % |
Количество иммобилизованного
фермента (по белку) |
|
|
мг/г сорбента |
% от содержания
фермента в растворе |
|||
|
Декстранокрем-неземный сорбент |
5,84 |
40 |
28,3 |
50 |
|
Аминокремнезем-ный сорбент |
9,49 |
65 |
7,8 |
44 |
Для определения
значения рН, при котором наблюдалась наибольшая ферментативная активность растворимой
и иммобилизованной b-галактозидазы, использовали растворы фосфатно-цитратного буфера с рН
2,58; 3,27; 4,21; 5,13; 6,15; 7,08; 7,71; 8,67. Полученные данные о влиянии рН
среды на активность иммобилизованной и растворимой b-галактозидазы представлены на рисунке 1.
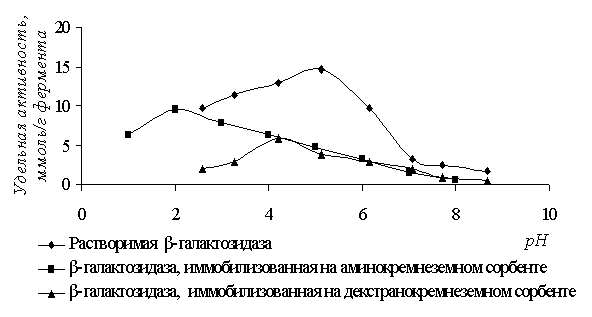
Рисунок 1 - Влияние значения рН на удельную
активность
растворимой и иммобилизованной b-галактозидазы
Смещение
оптимума рН в кислую, область объясняется общим свойством поликатионных матриц вызывать
неравномерное перераспределение протонов между фазой свободного раствора и
микроокружением фермента. Способность поликатионной матрицы к отталкиванию
протонов приводит к увеличению рН в микроокружении фермента и соответственно
уменьшению рН в свободном растворе [5].
Таким образом, несмотря на видимое смещение рН – профиля в кислую область (рН
2,9; 4,2) сам фермент, благодаря изменившемуся микроокружению, будет работать
при рН 5,13.
Для определения диапазона термостабильности
растворимой и иммобилизованной b-галактозидазы были использованы фосфатно-цитратные буферные растворы
со значениями рН, при которых наблюдалась наибольшая активность фермента.
Активность растворимой и иммобилизованной b-галактозидазы определяли в диапазоне температур от 10
до 700С при инкубации в течение 20 минут в фосфатно-цитратном
буферном растворе с рН 2,9 для иммобилизованной на аминокремнеземном сорбенте;
с рН 4,2 для фермента, иммобилизованного декстранокремнеземном носителе. Для растворимого
фермента значение рН фосфатно-цитратного буферного раствора составило 5,13 (рисунок 2).
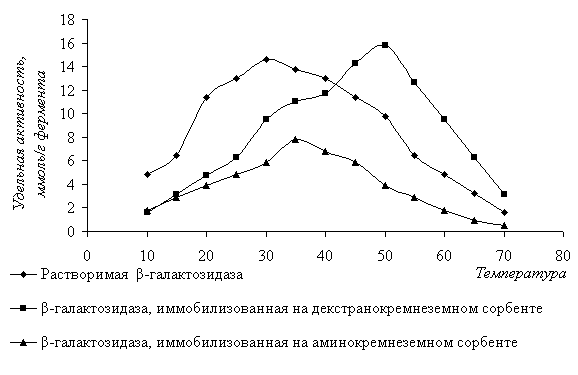
Рисунок
2 - Влияние температуры на удельную активность
растворимой
и иммобилизованной b-галактозидазы
Растворимая b-галактозидаза имеет оптимум термостабильности при 30°С,
удельная активность фермента при этом 14,6 ммоль/г фермента. Для иммобилизованной
b-галактозидазы диапазон
термостабильности значительно возрастает и лежит в пределах 30-50°С. При этом
для b-галактозидазы,
иммобилизованной на декстранокремнеземном сорбенте оптимум активности
составляет 15,8 ммоль/г фермента при температуре 50 0С. Иммобилизованный
препарат фермента на аминокремнеземном сорбенте имеет оптимум удельной активности
7,8 ммоль/г фермента при 35°С.
Процесс денатурации
белка рассматривается как обратимый и имеется возможность найти условия, при
которых происходит регенерация нативной структуры белка. Одним из таких
факторов является процесс иммобилизации. Наблюдаемые изменения устойчивости
иммобилизованной b-галактозидазы к термоинактивации, вероятно, связаны как с кинетической,
так и термодинамической стабильностью. Надмолекулярная структура носителя
оказывают стабилизирующее действие на молекулу энзима. Иммобилизация фермента
на декстранокремнеземном носителе
обеспечивает термостабидьность b-галактозидазы большую, чем растворимого фермента.
Сравнительные
характеристики растворимой и иммобилизованной b-галактозидазы представлены в таблице 2.
Таблица 2 - Сравнительные
характеристики растворимой и иммобилизованной b-галактозидазы
Свойства
|
Растворимая b- галактозидаза |
Иммобилизованная b- галактозидаза |
|
Оптимум активности фермента,
t°С |
30 |
30-50 |
|
Оптимум рН |
5,13 |
2,9;
4,2 |
|
Диапазон термостабильности, t°С |
30 |
30-50 |
|
Сохранение активности во времени |
2 недели |
Более 2-х месяцев |
|
Концентрация раствора субстрата
– лактозы |
5,0% |
4,0-5,0 % |
|
Кратность использования |
1 |
5 |
Таким образом, в ходе экспериментальных
исследований были получены иммобилизованные препараты ß-галактозидазы на декстранокремнеземном
и аминокремнеземном сорбентах. Установлены оптимальные технологические режимы
процесса гидролиза лактозы для свободного и иммобилизованного фермента
ß-галактозидазы: температура - 30-50°С, рН раствора субстрата –2,9; 4,2; 5,13; оптимум
концентрации раствора субстрата лактозы 4,0 – 5,0 %.
Полученные препараты могут
быть использованы в медицинской диагностике
при определении некоторых опухолей пищеварительного тракта, в результате
которых изменяется содержание лактозы в моче, а также в пищевой промышленности
для создания безлактозных и низколактозных продуктов питания на молочной основе.
ЛИТЕРАТУРА
1.
Рахимов К.Р. Механизм
усвоения лактозы в онтогенезе человека и животных. – Ташкент, 1991. –С. 381.
2.
Ridha S.H.,Crauford R., Tamine.A.I. The quality of
Cheddar cheose prodused from lactose hydrolysed milk //Dairy Ind. Int.- 1983.-
V. 48, №.12.- P. 17-22.
3.
Huzjak D., Huzjak Jasna, Krizanik J. The stability of
β – galaktosidase (Aspegillus oryzae) immobilized on Eupergit C // J. biotehnol. rew. – 1994. – V.32, № 4. – P.177
– 179.
4.
Куликова А.К., Летунова
Е.В. // Прикл. биохимия и микробиология.- 1970. - Т.20.- № 1. - С.133-137.
5.
Воробьева О.В.
Биосорбенты для иммобилизации белковых комплексов ферментных
препаратов//Биотехнология. – 2004. -№ 2. –С. 70-75.
6.
Брыкалов А.В. Получение
биопрепаратов на основе методов аффинной сорбции и иммобилизации. Дисс. … доктора хим. Наук. – Санкт-Петербург,
1993. – 330с.
7.
Меньшикова О.В.
Справочник: Лабораторные методы исследования в клинике. – М.: Медицина, 1987. – С. 26-27.