Медицина / 7.
к.т.н. Родионов И.В.
Саратовский государственный технический
университет
Клинические
испытания медицинских имплантатов с анодно-оксидными и термооксидными
биопокрытиями
Широкое применение медицинских костных имплантатов в стоматологии, травматологии, ортопедии обусловлено их возможностью замещать утраченные либо исправлять поврежденные костные структуры организма, обеспечивая полное восстановление функций скелета. Стоматологические имплантаты, предназначенные для лечения заболеваний и исправления дефектов челюстно-лицевой системы, представляют искусственные корни зубов или специальные пластины для сращения и коррекции поврежденной костной ткани челюсти либо костей черепно-лицевой области. Они действуют в организме на протяжении длительного времени (20 и более лет) и имеют постоянный характер функционирования. К ортопедическим имплантатам относятся конструкции, используемые для восстановления функций различных суставов, коррекции сегментов позвоночника, лечения переломов конечностей, исправления деформаций костей и т.д. Подобными имплантатами в большинстве случаев служат стержневые и спицевые остеофиксаторы аппаратов внешней фиксации, позволяющие осуществлять направленный остеосинтез поврежденных частей кости. Такие имплантаты находятся в организме в течение короткого периода времени (7-8 недель), необходимого для лечения костной патологии, и впоследствии удаляются из кости.
Материалами стоматологических имплантатов часто являются титан и его сплавы, обладающие требуемым уровнем биологических и механических свойств при взаимодействии с биосредой. Материалом ортопедических имплантатов в большинстве случаев выступает биотолерантная хромоникелевая сталь 12Х18Н9Т, 12Х18Н10Т, способная выдерживать значительные механические нагрузки от костного сегмента. При этом на поверхности титановых и стальных имплантатов можно получать оксидное покрытие с определенными показателями фазово-структурного состояния и поверхностного строения, придающими металлоимплантатам высокий уровень биомеханической совместимости. Покрытие на стоматологических титановых имплантатах целесообразно формировать путем электрохимического оксидирования, исключающего образование в покрытии малопрочных и низко коррозионностойких титанонитридных фаз, возникающих при газотермическом окислении титана. Оксидный слой на ортопедических имплантатах с необходимыми функциональными качествами легко создается с использованием способов воздушно-термического и паротермического оксидирования. Однако клиническое испытание биоинтеграционной способности имплантатов с электрохимическими и газотермическими оксидными биопокрытиями ранее не проводилось, поэтому целью исследования является оценка уровня адаптации оксидированных имплантатов в костных структурах лабораторных животных.
Методика клинического испытания имплантатов с оксидными
биопокрытиями
на лабораторных животных
Опытные
имплантаты представляли винтовые
стержни из технического титана ВТ1-00, титанового сплава ВТ-16 и нержавеющей
стали 12Х18Н9Т – металлов, которые обладают необходимой биомеханической
совместимостью (рис. 1). Стержни изготовлялись путем токарной обработки и
подвергались ультразвуковому обезжириванию, а также пескоструйной обдувке
поверхности для удаления загрязняющих слоев, создания исходной микрошероховатости и химической активации. Формирование
оксидных покрытий на опытных имплантатах-остеофиксаторах осуществлялось с
применением электрохимического и некоторых видов термического оксидирования.
Рис. 1. Внешний вид опытных стержневых имплантатов-остеофиксаторов

Анодное оксидирование использовалось для получения покрытий на титановых фиксаторах
и проводилось в сернокислом электролите 200 г/л Н2SO4 с добавкой сульфата меди 50 г/л CuSO4 · 5 Н2О при режимах электролиза i = 50 мА/см2, t = 25-300С, τ =
0,9 ч. При этом серии анодированных титановых фиксаторов обозначались буквой Т
и соответствовали номерам: Т1 – анодированный титан ВТ1-00, Т2 –
анодированный титановый сплав ВТ-16.
Термическое
оксидирование применялось для
создания покрытий на стальных остеофиксаторах и осуществлялось с использованием
двух способов химико-термической обработки: воздушно-термического и паротермического
оксидирования.
При
воздушно-термическом оксидировании имплантатов-фиксаторов применялись воздушная
атмосфера в печи и температуры обработки 400, 500, 600, 7000С с
продолжительностью 0,5 ч при каждой температуре. Паротермическое оксидирование
выполнялось при температуре 5500С и выдержке 2 ч в атмосфере
перегретого водяного пара. Принятые режимы оксидирования позволили получить
покрытия на остеофиксаторах с определенным уровнем плотности, прочности и
однородности свойств.
Серии опытных
фиксаторов из нержавеющей стали обозначались буквой С и характеризовались
как С1 – токарная обработка; С2 – пескоструйная обработка; воздушно-термическое
оксидирование при температурах: С3 – 4000С; С4 – 5000С;
С5 – 6000С; С6 – 7000С; С7 –
паротермическое оксидирование при температуре 5500С.
Коррозионно-электрохимическое
поведение опытных имплантатов-фиксаторов с воздушно-оксидными и
парооксидными покрытиями изучалось при использовании физиологического раствора
0,9% NaCl для моделирования условий взаимодействия имплантатов
с жидкими биосредами организма. Исследования проводились на специальной
лабораторной установке с определением коррозионного потенциала Ес оксидированной поверхности
при температурах физиологического раствора 25, 30, 35, 40, 450С.
Данная методика применялась для измерения потенциалов поверхности у трех
опытных фиксаторов каждой из С-серии.
Коррозионные
потенциалы измерялись как до клинических испытаний биоинтеграционных качеств
фиксаторов с их установкой в кости животным, так и после проведения клинических
испытаний с удалением фиксаторов из костей. После удаления фиксаторы в течение
3 суток хранились в физиологическом растворе, затем промывались в дистиллированной
воде, просушивались на воздухе и использовались для измерения потенциала.
По результатам измерения потенциала рассчитывалось его среднее значение для фиксаторов каждой С-серии и устанавливались зависимость потенциала от температуры термооксидирования, а также от температуры физиологического раствора. Изменение потенциала как показателя коррозионно-электрохи-мической стойкости и анализ вида поверхности фиксаторов после клинических испытаний использовались для оценки их биоинтеграционных качеств.
Клинические
испытания биоинтеграционной способности опытных имплантатов-фиксаторов
как без покрытия, так и с анодно-оксидным, воздушно-оксидным, парооксидным
покрытиями проводились в специальных стационарных условиях ветеринарных клиник
г. Саратова и области на кроликах породы «нидерландская красная» и «черный великан».
Животные имели возраст 9 месяцев, живую массу 4,5-5,0 кг и были разделены на несколько
опытных групп, включающих от 3 до 5 животных.
Для испытания
анодированных титановых фиксаторов серий Т1 и Т2 использовались
две опытные группы кроликов породы «нидерландская красная», отмеченные соответственно
буквой Т. Клинические испытания термооксидированных стальных фиксаторов
серий С1-С7 проводились на семи группах кроликов породы «черный
великан», соответствующих обозначению С-групп.
Животным
под нейролептаналгезией рометаром и золетилом выполнялся флексионный перелом
большой берцовой кости в области средней трети диафиза, затем в отломках
просверливались каналы для вворачивания оксидированных фиксаторов. Учитывая,
что прочностные характеристики кости на разных участках ее длины имеют
значительные отличия, фиксаторы каждой серии устанавливались как в
метафизарные, так и в диафизарные участки кости животных опытных групп.
Фиксаторы вворачивались вручную с помощью рукоятки из комплекта аппарата Г.А. Илизарова, после чего проводилась закрытая репозиция костных отломков. Их внешняя фиксация выполнялась в аппарате, состоящем из кронштейнов и многодырчатой планки.
В постоперационный период всем животным проводилась превентивная антибиотиковая терапия цефазолином, а также санация зоны контакта «фиксатор – кость» 3% раствором перекиси водорода, выполнялись клинические и морфологические исследования.
Клиническая оценка биоинтеграционных качеств фиксаторов проводилась путем выявления характеристик состояния животных, включающих регистрацию температуры организма, поведение животных, опороспособность конечности, микроподвижность фиксаторов, реакцию животных на прижатие фиксаторов, а также по признакам развития воспалительных осложнений с использованием микробиологического исследования мазков, патологического исследования при вскрытии погибших животных, по уровню сопротивления вывертыванию фиксаторов.
Результаты
испытания и их анализ
Биоинтеграционная
способность анодированных титановых имплантатов
Клиническое испытание анодированных остеофиксаторов на животных двух опытных Т-групп показало, что функциональные характеристики покрытий, благоприятно влияют на процесс приживления фиксаторов в костных структурах и обеспечивают интеграцию оксидированной поверхности с окружающей тканью (рис. 2).
Оптико-микроскопические исследования показали, что на поверхности извлеченных титановых фиксаторов имеется значительная площадь, занимаемая частицами костной ткани животных и отсутствуют какие-либо признаки протекания коррозии, что говорит о высокой биоинтеграционной способности сформированных анодно-оксидных покрытий. Об этом свидетельствует и то, что в течение всего периода функционирования анодированных фиксаторов, составляющего 45 суток, не происходило существенного воспаления биоструктур, расшатывания фиксаторов и смещения костных отломков. Данные явления обусловлены наличием высокой коррозионно-электрохимической стойкости покрытий, полученной прочностью закрепления фиксаторов в кости и жесткостью фиксации аппарата остеосинтеза.

а б
Рис. 2. Внутрикостная часть
анодированных титановых остеофиксаторов с костными фрагментами после 45 суток
клинического испытания (х45): а – анодированный фиксатор из титана ВТ1-00,
б – анодированный фиксатор из титанового сплава ВТ-16
В результате совокупность указанных биотехнических характеристик способствовала ускоренной консолидации кости и эффективному сращению переломов конечностей у животных обеих опытных групп Т (табл. 1). По истечении периода лечения фиксаторы удалялись из костей с помощью ключа, создавая при этом значительное сопротивление вывертыванию, что обусловлено интеграцией покрытий с костной тканью.
Таким образом, анодно-оксидные покрытия, получаемые на пескоструйно-обработанных
поверхностях костных титановых имплантатов-фиксаторов, обладают способностью
эффективного физико-механического взаимодействия с биоструктурами и
формирования прочной системы «имплантат с покрытием – кость». Кроме того,
присутствие в составе титанооксидного покрытия ионов Cu способствует выполнению им
антисептической функции с предотвращением протекания длительных воспалительных
реакций в биосреде имплантационной зоны. Об этом свидетельствуют результаты
микробиологического анализа мазков экссудата, показавшие отсутствие патогенной
микрофлоры в раневой области (табл. 1).
Таблица 1
Протокол клинического испытания стержневых титановых
имплантатов-фиксаторов с анодно-оксидным биопокрытием на лабораторных животных
|
Материал имплантатов |
Технический титан ВТ1-00 |
Титановый сплав ВТ-16 |
|
Метод обработки |
Анодное оксидирование пескоструйно-обработанных имплантатов в электролите 200 г/л H2SO4+50 г/л СuSO4·5Н2О при плотности тока 50 мА/см2, температуре 250С, продолжительности электролиза 0,9 ч |
|
|
Состав покрытия |
Смесь из оксидов титана и оксида меди |
|
|
Группа животных |
Т1 |
Т2 |
|
Количество животных |
5 |
5 |
|
Дата установки аппарата с имплантатами |
14 мая 2007 г. |
|
|
Костный сегмент |
Большая берцовая кость |
|
|
Вид перелома |
Флексионный, в средней трети диафиза |
|
|
Время появления естественной воспалительной реакции на имплантат |
3 суток |
3 суток |
|
Период полного сращения перелома |
4 недели |
5 недель |
|
Дата снятия аппарата |
28 июня 2007 г. |
|
|
Внешний вид поверхности имплантатов |
Шероховатая, со значительными костными фрагментами |
|
|
Результаты микробиологического анализа мазков экссудата имплантационной зоны |
Отсутствие патогенной микрофлоры и аллергической реакции тканей |
|
Проведенные анализ и оценка влияния биоинтеграционных свойств анодно-оксидных покрытий на характер их взаимодействия с костными структурами, прочность закрепления и уровень приживления имплантатов в организме, указывает на высокую способность разработанных покрытий адаптироваться к окружающим костным и мягким тканям, а также жидким биосредам в различных имплантационных условиях.
Биоинтеграционная способность термооксидированных
стальных имплантатов
Определение биоинтеграционных качеств
стальных имплантатов-остеофиксаторов с воздушно-оксидными и парооксидными
покрытиями характеризовалось анализом коррозионного поведения изделий как до,
так и после проведения клинических испытаний.
Коррозионное
поведение поверхности фиксаторов
серии С1, изготовленных с применением токарной обработки, до выполнения
клинических испытаний обусловливалось небольшими отрицательными значениями потенциала
Ес. С ростом температуры модельного физиологического раствора
потенциалы несколько уменьшались от – 0,095 В до – 0,058 В (табл. 2).
Применение пескоструйной обработки фиксаторов серии С2 вызывало заметное
уменьшение величины отрицательных потенциалов, которые изменялись от – 0,085 В до – 0,042 В. Небольшие
отрицательные потенциалы поверхности фиксаторов обеих С-серий
свидетельствуют об их невысокой электрохимической активности и определенной
коррозионной стойкости. Это связано, по-видимому, с наличием защитных свойств
естественной очень тонкой пленки сложного оксида Fe и Cr, образующейся
на стальных фиксаторах при действии воздуха. Пескоструйная обработка создавала
лучшую микрошероховатость и окисляемость поверхности, с ростом температуры
натрийхлоридного раствора могло происходить уплотнение оксидной пленки, что
формировало уменьшение отрицательных потенциалов (рис. 3).
Таблица 2
Изменение коррозионного потенциала различных поверхностей стальных
имплантатов-фиксаторов до и после клинических испытаний
|
№ опытной серии |
Вид обработки поверхности |
Температура раствора 0,9% NaCl, 0С |
||||||||||
|
25 |
30 |
35 |
40 |
45 |
||||||||
|
Потенциал поверхности Ес,
В |
||||||||||||
|
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
до исп. |
после исп. |
|||
|
С1 |
Подготовка |
Токарная |
-0,095 |
-0,161 |
-0,083 |
-0,159 |
-0,072 |
-0,160 |
-0,066 |
-0,162 |
-0,058 |
-0,159 |
|
С2 |
Пескоструйная |
-0,085 |
-0,146 |
-0,076 |
-0,145 |
-0,066 |
-0,144 |
-0,054 |
-0,154 |
-0,042 |
-0,154 |
|
|
С3 |
Воздушно-терм.
окси-дирование, τ = 0,5 ч, t, 0С |
400 |
-0,349 |
-0,092 |
-0,350 |
-0,103 |
-0,352 |
-0,108 |
-0,351 |
-0,109 |
-0,351 |
-0,107 |
|
С4 |
500 |
-0,359 |
-0,103 |
-0,365 |
-0,104 |
-0,372 |
-0,099 |
-0,380 |
-0,086 |
-0,414 |
-0,078 |
|
|
С5 |
600 |
-0,362 |
-0,152 |
-0,364 |
-0,152 |
-0,387 |
-0,158 |
-0,402 |
-0,154 |
-0,412 |
-0,167 |
|
|
С6 |
700 |
-0,375 |
-0,196 |
-0,407 |
-0,152 |
-0,415 |
-0,130 |
-0,424 |
-0,151 |
-0,435 |
-0,133 |
|
|
С7 |
Паротерм. оксидирование, t = 5500С, τ = 2 ч |
-0,343 |
-0,145 |
-0,339 |
-0,151 |
-0,335 |
-0,153 |
-0,333 |
-0,154 |
-0,332 |
-0,154 |
|
Воздушно-термическое
оксидирование фиксаторов приводило к образованию покрытий с потенциалами более
отрицательными в сравнении с фиксаторами до оксидирования (табл. 2). Такой
сдвиг потенциалов объясняется, вероятнее всего, повышенной толщиной оксидных
покрытий, из-за чего происходят рост внутренних напряжений и числа микронесплошностей
структуры, а также высоты микронеровностей. В таких условиях обычно возрастает
электрохимическая активность поверхности с увеличением отрицательного потенциала.
По этой же причине, возможно, происходит повышение отрицательных значений
потенциала покрытия с ростом температуры оксидирования фиксаторов серии С3,
С4, С5, С6 от – 0,349 В при температуре 4000С
до – 0,435 В при температуре 7000С. Такое же влияние нагрева
модельного раствора на снижение потенциала поверхности может быть связано с
увеличением подвижности ионов в растворе и активизацией электродных процессов
(рис. 3). Покрытие стальных фиксаторов серии С3, полученное при
температуре оксидирования 4000С, обладало наименьшим отрицательным
потенциалом, равным – 0,349 В, который почти не изменялся с нагревом раствора.
Это обусловлено наилучшим сочетанием толщины и плотности данного вида покрытия,
что придает ему повышенную электрохимическую устойчивость.
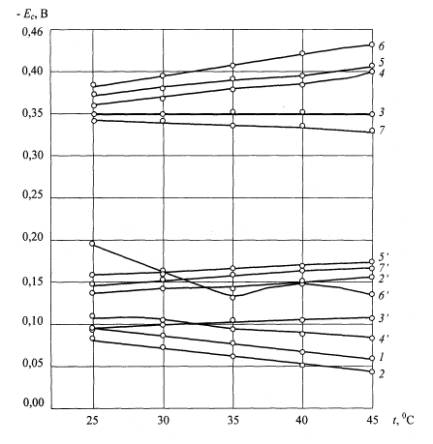
Рис. 3. Влияние вида
обработки поверхности стальных фиксаторов и температуры физраствора на
изменение коррозионных потенциалов: 1 – токарная обработка; 2 –
пескоструйная обработка; 3, 4, 5, 6 – воздушно-термическое оксидирование
при 4000С, 5000С, 6000С, 7000С
соответственно; 7 – паротермическое оксидирование (штрихом обозначены
температурные зависимости потенциалов поверхностей после клинических испытаний
фиксаторов)
Паротермическое оксидирование создавало на поверхности фиксаторов серии
С7 покрытие, минимальный отрицательный потенциал которого составлял –
0,332 В и был меньше потенциала покрытий, полученных воздушно-термической обработкой.
Повышение температуры раствора оказывало небольшое влияние на изменение
потенциала (рис. 3). Возможным объяснением этого служат повышенная структурная
плотность парооксидного покрытия и улучшенная микрошероховатость поверхности.
Клинические
испытания,
выполняемые в период первой недели после операции, не позволили выявить
значимых отличий состояния животных в опытных С-группах. У 7-ми животных
регистрировалось повышение температуры до 39,20С в течение 3-х
суток, отказ от корма и воды отмечался в течение 2-х суток у 12-ти животных.
Опора животных на оперированную конечность наблюдалась уже на следующие сутки,
в дальнейшем опороспособность не нарушалась.
При локальном обследовании всех животных отмечалась ярко выраженная картина воспаления в зоне «фиксатор – кость» уже через сутки после операции. В это время отчетливо просматривались отечность и гиперемия мягких тканей, их болезненность при пальпации. Однако при этом не наблюдалось микроподвижности фиксаторов и, как следствие, перемещения отломков, что свидетельствует о высоком качестве выполненной их фиксации.
В первые
четверо суток у 8-ми животных была отмечена незначительная экссудация из-под
остеофиксаторов, которая прекратилась без дополнительных лечебных воздействий.
Данное явление может быть обусловлено мацерацией мягких тканей, возникающей при
вворачивании остеофиксаторов.
Проведенные
микробиологические исследования мазков, полученных на границе фиксаторов и
мягких тканей, не выявили наличия патогенной микрофлоры. При этом в незначительном
количестве были идентифицированы эпидермальные стафилококки, кишечная палочка и
энтерококки, которыми могла быть загрязнена рана при воздействии внешней среды.
По
истечении первой недели клиническая картина, характеризующая состояние животных,
существенно изменилась с признаками влияния вида оксидного покрытия стальных
фиксаторов.
У
животных С3 и С4 групп практически исчезли симптомы воспаления
мягких тканей – гиперемия и отечность, пальпация мягких тканей не вызывала у
них беспокойства, микроподвижность фиксаторов отсутствовала. Кожа на границе с
фиксатором не была инфильтрирована, что характеризовало нормализацию
гемодинамики в зоне контакта «фиксатор – кость» за достаточно короткое время.
Приведенные данные позволяют считать, что установленные животным стальные
остеофиксаторы с покрытием, созданным путем воздушно-термического оксидирования
при температурах 400 и 5000С, обеспечивают начало процесса его
биоинтеграции.
Животные
С1, С2 и С7 групп также характеризовались положительной
динамикой состояния мягких тканей на границе с фиксатором. Однако малозаметная
отечность, слабая гиперемия и незначительная экссудация из-под фиксаторов могут
свидетельствовать о некотором раздражении биотканей в зоне контакта с
поверхностью, обработанной резцом, пескоструйной обдувкой и паротермически
оксидированной при температуре 5500С.
У
животных С5 и С6 групп при осмотре оперированных конечностей уже
через трое суток после операции отмечался значительный отек, болезненность
мягких тканей с последующим их потемнением вокруг фиксаторов и повышенной
экссудацией, перешедшей затем в гнойную. При микроскопическом исследовании
отделяемого были обнаружены фрагменты металлооксида из состава покрытий,
полученных путем воздушно-термического оксидирования при температурах 600 и 7000С.
Животные этих групп проявляли вялость, сидели скученно, нажим на фиксаторы
вызывал их беспокойство. Через неделю после операции пали двое животных С6
опытной группы и одно животное С5 группы. Данные результаты могут характеризовать непрочность оксидного покрытия
на фиксаторах, из-за чего произошло отделение его частиц с развитием на металлической
поверхности коррозионных процессов, инфицирование биоткани в зоне контакта с
последующей гибелью животных.
При вскрытии и патологоанатомическом исследовании животных были отмечены дистрофия паренхиматозных органов (лимфоузлы, печень), наличие гнойных очагов в кости вокруг остеофиксаторов в коленном и запястном суставах. Остальным животным этих групп после подтитровки к антибиотикам была проведена дополнительная терапия иммунномодуляторами с последующей секвестроэктомией.
Изменения в состоянии тканей вокруг фиксаторов и в положении аппаратов
на конечностях животных всех опытных С-групп, выявленные через месяц
после остеофиксации, были, очевидно, связаны со свойствами поверхности
фиксаторов, сформированными различными методами механической обработки и термического
оксидирования (табл. 3).
Таблица 3
Протокол клинического испытания стальных
имплантатов-фиксаторов с термооксидными покрытиями на
лабораторных
животных
|
Материал фиксаторов |
Сталь 12Х18Н9Т |
||||
|
Метод обработки |
Воздушно-термическое
оксидирование |
Паротермическое
оксидирование |
|||
|
Температура обработки, 0С |
400 |
500 |
600 |
700 |
550 |
|
Серия |
С3 |
С4 |
С5 |
С6 |
С7 |
|
Кол-во животных |
3 |
3 |
3 |
3 |
3 |
|
Дата установки аппарата |
14 сентября 2007 г. |
||||
|
Костный сегмент |
Большая берцовая кость |
||||
|
Вид перелома |
Флексионный, в средней
трети диафиза |
||||
|
Время появления воспалительных
осложнений |
- |
- |
3 сут. |
3 сут. |
3 сут. |
|
Время появления расшатывания |
- |
- |
7 сут. |
7 сут. |
21 сут. |
|
Период полного сращения
перелома |
4 нед. |
4 нед. |
- |
- |
5 нед. |
|
Дата
снятия аппарата |
28 октября 2007 г. |
||||
|
Внешний
вид поверхности фиксатора |
Шероховатая, со значительными
костными фрагментами |
Шероховатая, со значительными
костными фрагментами |
Гладкая, со значительными
участками коррозии |
Гладкая, со значительными
участками коррозии |
Шероховатая, со значительными
костными фрагментами |
Животные С3 и С4 групп характеризовались отсутствием
воспалительных реакций и отделяемого
вокруг фиксаторов как в метафизарных, так и в диафизарных отделах кости. Общее
состояние животных было удовлетворительным, они охотно принимали корм и воду,
передвигались по клетке. Нажим на аппарат в целом и на каждый фиксатор в
отдельности не вызывали негативной реакции животных, микроподвижности
фиксаторов не регистрировалось.
У животных остальных опытных групп к этому времени отмечалась экссудация вокруг фиксаторов более заметная в метафизах, а у животных С5 группы она наблюдалась и в диафизах. При этом небольшое «шатание» аппаратов, регистрируемое как пальпаторно, так и визуально, вызывало беспокойство животных.
Вышеуказанная тенденция сохранилась и на момент
окончания эксперимента – по истечении 45 суток. Для извлечения фиксаторов из
костей животных С3 и С4, С7 групп было необходимо их
вывертывание с помощью ключа, у животных С1, С2 групп фиксаторы
из диафизарных отделов вывертывались также ключом, из метафизов – вручную. Из
костей животных С5 и С6 групп фиксаторы вывертывались вручную без
значительного сопротивления.
Отсутствие
существенных воспалительных осложнений у животных С3, С4 и С7
групп в ранний постоперационный период (7 суток), отсутствие микроподвижности
фиксаторов в отдаленный период (45 суток), необходимость применения ключа для
вывертывания фиксаторов по окончании эксперимента могут служить клиническим
свидетельством наличия биоинтеграции оксидных покрытий фиксаторов, полученных
воздушно-термической обработкой при температурах 400 и 5000С, а
также паротермическим оксидированием при температуре 5500С [333].
Коррозионное
поведение поверхности стальных
фиксаторов после проведения клинического исследования их биоинтеграционных
свойств отличалось значительным смещением коррозионного потенциала в
положительную сторону за исключением неоксидированных фиксаторов серий С1
и С2.
Прошедшие токарную обработку фиксаторы серии С1 приобрели
потенциал, мало зависящий от температуры физиологического раствора, средней величиной
– 0,160 В. Это на – 0,065 В более отрицательное значение, чем самый отрицательный
потенциал фиксатора до клинического исследования (рис. 3). Фиксаторы серии С2
имели среднюю величину потенциала, равную – 0,149 В, что было на – 0,064 В
меньше самого отрицательного потенциала до клинического эксперимента.
Полученный сдвиг потенциала в отрицательную сторону может быть объяснен
возможностью повреждения тонкой естественной пленки оксидов, имеющей катодный
характер, при вворачивании фиксаторов с воздействием в течение 45 суток
биожидкости на данную пленку. По указанной причине поверхность фиксаторов имела
незначительные следы костных частиц, характеризующие ее слабые биоинтеграционные
качества (рис. 4).

Рис.
4. Стальной остеофиксатор с пескоструйно-обработанной поверхностью и мелкими
костными частицами после клинического испытания
Воздушно-термическое
оксидирование фиксаторов серий С3 и С4 при температурах 400 и 5000С
обеспечило получение положительного сдвига потенциала покрытий в среднем на
0,247 В и 0,284 В соответственно; покрытие на фиксаторах серии С5,
полученное при температуре 6000С дало средний положительный сдвиг
потенциала на 0,228 В (рис. 3). Указанное явление, по-видимому, связано с тем,
что наличие значительного числа структурных микронесплошностей и увеличенной
высоты неровностей поверхности придавало оксидным покрытиям качества
остеокондуктивности. При этом на поверхности фиксаторов наблюдалось присутствие
частиц костной ткани, оставшихся после удаления фиксаторов путем их
вывертывания из костных отломков (рис. 5-7). В этих условиях частицы ткани
наибольшего размера сохранились на поверхности одного-двух последних витков
винтовой части фиксаторов, на других витках частицы имели вид мелких точечных
включений. Данные признаки указывают на биоинтеграцию оксидных покрытий с
прорастанием в поверхностные микронесплошности костных структур, которые
отделились от кости и поверхности покрытия вследствие боковых сил сдвига,
возникших при вывертывании фиксаторов. В результате краткого действия сдвиговых
сил вывертывания на последних витках сохранились более крупные костные
фрагменты, чем на других витках, испытавших многократное воздействие сил
сдвига.

а
б
Рис.
5. Стальной остеофиксатор с оксидным покрытием, полученным воздушно-термическим
оксидированием при 4000С после клинического исследования: а –
общий вид, б – последние витки с крупными фрагментами костной ткани

а
б
Рис. 6. Стальной остеофиксатор с оксидным покрытием, полученным воздушно-термическим оксидированием при 5000С после клинического исследования: а – вид резьбовой части, б – фрагменты костной ткани на поверхности витков

после
7 суток
после
14 суток
после
21 суток
а
б
Рис. 7. Стальные остеофиксаторы с оксидным покрытием, полученным воздушно-термическим
оксидированием при 6000С после клинического исследования: а –
вид поверхности фиксаторов после извлечения из костей на различных этапах
имплантации, б – участок поверхности с костными частицами и следами коррозии
Температура
оксидирования 7000С фиксаторов серии С6 создавала повышенные
внутренние напряжения и малопрочное покрытие с положительным сдвигом потенциала
в среднем на 0,259 В (табл. 2). Это можно объяснить появлением на поверхности
оксидного покрытия пленки белковых структур, имеющей хорошие защитные свойства.
Данное покрытие могло разрушиться при вворачивании фиксаторов с образованием
отделившихся частиц оксида и их попаданием в тканевую жидкость. Это могло
способствовать появлению воспалительных осложнений и исключить возможность
биоинтеграции покрытия. Анализ поверхности фиксаторов после их испытания
показал, что покрытие имеет слабо выраженные признаки биоинтеграции с наличием
значительных зон коррозионного разрушения металла, возникших в результате отделения частиц покрытия от
поверхности фиксатора (рис. 8).
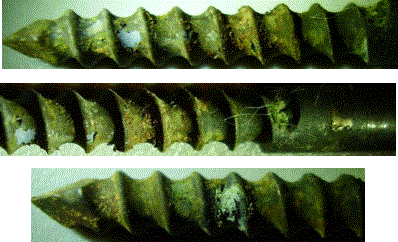
Рис. 8. Серия стальных остеофиксаторов
с оксидным покрытием, полученным воздушно-термическим оксидированием при 7000С
и имеющим значительные участки коррозии после клинических испытаний
Паротермическое
оксидирование фиксаторов серии С7 формировало покрытие, у которого
коррозионный потенциал стал более положительным в среднем на 0,185 В (табл. 2).
Это может быть связано с теми же причинами, которые были приведены выше при
анализе поведения фиксаторов серии С6 с оксидным покрытием, полученным
воздушно-термической обработкой при температуре 7000С.
Биоинтеграционные качества парооксидного покрытия находились на высоком уровне
и характеризовались явно выраженными признаками интеграции поверхности с
костной тканью (рис. 9).

Рис. 9. Стальной
остеофиксатор с оксидным покрытием, полученным паротермическим оксидированием
при 5500С и имеющим тонкий слой костной ткани после клинического испытания
На основании
результатов проведенных коррозионно-электрохими-ческих исследований и
клинических испытаний можно заключить, что металлоимплантаты с разработанными
анодно-оксидными и термооксидными покрытиями обладают высокой биоинтеграционной
способностью и хорошей коррозионной стойкостью в биосредах. При этом, как было
установлено, технологический режим и условия термического оксидирования стержневых
остеофиксаторов из стали 12Х18Н9Т оказывают наибольшее влияние на электрохимическую
активность и биоинтеграционные качества оксидных покрытий при лабораторных и
клинических исследованиях.
До проведения
клинических испытаний коррозионные потенциалы поверхности стальных фиксаторов
после токарной обработки и пескоструйной обдувки имели небольшие отрицательные
значения, которые несколько уменьшались в пределах от – 0,095 В до – 0,042 В
при повышении температуры модельного физиологического раствора, что связано с
изменением защитных свойств естественной оксидной пленки на стали.
Остеофиксаторы с
воздушно-оксидными и парооксидными покрытиями обладали значительно более
отрицательными потенциалами, которые либо не изменялись, либо немного
увеличивались с ростом температуры раствора, так что при температуре 400С
потенциалы составляли величину от – 0,154 В для паротермического оксидирования
до – 0,435 В для воздушно-термического оксидирования при наибольшей температуре
обработки 7000С. Причиной этого является наличие на стальных
имплантатах-фиксаторах участков без покрытия, образовавшихся вследствие
отделения частиц оксида от поверхности металла из-за большой толщины покрытия и
значительных внутренних напряжений, возникших в нем при повышенных температурах
обработки. Это обусловливает снижение защитных свойств и механической прочности
оксидных покрытий при взаимодействии с биоструктурами.
Выводы
Клинические испытания показали, что наилучшими биоинтеграционными
свойствами характеризовались покрытия, полученные сернокислотным анодированием
титановых имплантатов-фиксаторов при i = 50 мА/см2, t = 25-300С, τ = 0,9 ч, а также покрытия, полученные воздушно-термическим
оксидированием стальных остеофиксаторов при температурах 400 и 5000С;
фиксаторы без покрытия проявили отсутствие выраженной биоинтеграционной
способности; стальные фиксаторы оксидированные с помощью паротермической
обработки при температуре 5500С обеспечили надежную биоинтеграцию;
фиксаторы, полученные воздушно-термическим оксидированием при температурах 600
и 7000С, обладали слабо выраженными биоинтеграционными свойствами,
вызывали сильное воспалительное осложнение окружающих тканей и имели значительные
участки коррозионного разрушения.
В связи с этим при восстановлении утраченных либо поврежденных корней зубов могут использоваться внутрикостные титановые имплантаты постоянного функционирования с анодно-оксидным биопокрытием, а для проведения наружного чрескостного остеосинтеза рекомендуется применять временные фиксаторы из стали 12Х18Н9Т с оксидными покрытиями, полученными воздушно-термическим оксидированием при температурах 400 и 5000С, а также паротермическим оксидированием при температуре 5500С. Данные оксидные покрытия обладают высокими качествами биоинтеграции и обеспечили эффективные результаты лечения при клинических испытаниях.