Экология /6. Экологический
мониторинг
магістрант
Косович К.О., к.т.н Дичко А.О.
Національний
технічний університет України «КПІ», Україна
Дослідження ферментів з метою
створення кондуктометричних біосенсорів
Класичний кондуктометричний метод вимірювань використовують у
ферментативному каталізі для визначення концентрацій певних речовин та
активності ферментів. Селективність у цьому випадку досягається завдяки саме
ферментам, які каталізують тільки певні реакції. В даному випадку мова не
йдеться про біосенсори, це лише використання методу для потреб ензимології.
Одну з перших робіт подібного плану було
опубліковано у 1961 році, де було показано можливість визначення вмісту
сечовини у розчині [3, C. 138 – 142]. Метод визначення концентрації сечовини базувався на
відмінності в електричній провідності розчинів сечовини та карбонату амонію,
який утворюється в ході реакції гідролізу сечовини під дією уреази. У 1965 р.
була опублікована робота, в якій кондуктометричний метод було застосовано для
вивчення кінетики ферментативного гідролізу сечовини, а також для визначення
активності уреази [3, C. 138 – 142].
В той же час була опублікована
робота [4, C. 126 − 129], в
якій авторами було показано, що зміна провідності в ході ферментативної реакції
може служити універсальною характеристикою глибини хімічних перетворень
субстратів. Щоб експериментально перевірити можливості кондуктометрії, авторами
було вибрано реакції, які зумовлюють різні механізми зміни провідності
розчинів. Важливо було встановити характер зміни провідності як у випадку явної
зміни іонного складу розчину, так і тоді, коли в ході реакції змінюється тільки
в’язкість розчину та ступінь гідратації молекул. Тому досліджували
ферментативний гідроліз ацетилхоліну та крохмалю, а також ферментативну деполімеризацію
гіалуронату. Авторами [4, C. 126
− 129] було показано, що кондуктометричний метод є досконалішим,
забезпечує більшу точність та меншу трудоємність у порівнянні з
загальновідомими методами біохімічного аналізу. За допомогою лише одного
приладу та одного методу без будь-яких модифікацій було знято кінетичні криві
трьох зовсім різних за своїм характером ферментативних процесів, тоді як при
класичному ферментативному аналізі потрібні були б три різні установки, які
працюють за різними принципами. В своїй наступній роботі [4, C. 126 − 129] автори модифікували свою
кондуктометричну установку і використали диференційний режим вимірювань для
вивчення активності коллагенази, трипсину, лактатдегідрогенази та
псевдохолінестерази .
На початку 80-х років на прикладі комплексного
вивчення уреази було проведено детальний аналіз можливостей та обмежень
кондуктометричного методу вимірювань [2, C. 373-396]. В роботі досить вдало наведено приклад успішного
використання кондуктометричного методу для вивчення ферментативної активності
уреази, показано дуже високу чутливість методу та збіг кінетичних параметрів,
визначених за допомогою класичних і електрохімічних методів. В роботах авторами
було використано шестиканальний кондуктометр, за допомогою якого вивчено цілий
ряд різних ферментів. Базуючись на проведених дослідженнях, виділяються п’ять
факторів, які, кожен окремо чи в комбінації один з другим, спричинюють зміну
провідності, що дає змогу використовувати кондуктометричний метод для
реєстрації перебігу ферментативних реакцій. В роботі було також показано, що
кондуктометричний метод можна також використати для всіх реакцій, які
продукують зміни рН і визначаються, як правило, рН-титруванням. Чутливість цих
методів можна порівнювати, але кондуктометрія має певні переваги. Перш за все
така установка дешевша та простіша у використанні. Крім того, на відміну від
кондуктометрії титрометрію можна проводити лише в одному напрямку зміни рН, і
вона потребує складніших маніпуляцій при роботі. В роботі кондуктометричний метод було також використано для вивчення
пероглютаміл пептидази, було отримано константи Міхаеліса, які склали 0,34 мМ
та 0,47 мМ для похідних аланіну та тирозину відповідно.
Але, не
зважаючи на чисельні переваги, кондуктометричні методи мають ряд обмежень.
Відношення величини сигналу до рівня шумів не повинно бути нижче 3. В даному
випадку також певну роль грає концентрація буферу та інших інгредієнтів, які
можна додати до реакційної суміші. Присутність нереагуючих іонів в розчині
зменшує чутливість методу. Але буфери з низькою іонною силою можна використати
для визначення низьких концентрацій субстратів до тих пір, поки буде
виконуватись відношення сигнал/шум. Одним з недоліків кондуктометрії є також
малоспецифічність, його застосування не дає змоги відрізнити одну реакцію від
іншої, що може призвести до артефакту. Похибки можуть також вносити ємність
подвійного шару та поляризація електродів під час реакції.
Кондуктометричні
біосенсори – це дуже перспективний клас приладів, якому
притаманна висока чутливість. Але поки що створенню кондуктометричних
біосенсорів присвячено незначну кількість робіт, у деяких з них, до того ж,
описано застосування даного типу перетворювачів для контролю за хроматографією
та для створення хімічних сенсорів по визначенню вологості повітря та
концентрацій певних газів .
Як правило вважається, що оскільки рідини, що
аналізуються, в більшості своїй мають значну фонову провідність, що легко
змінюється під дією різноманітних факторів, то вибірковість, а таким чином, і
можливість використання кондуктометричного методу реєстрації, мала. Але у
випадку інтегральних мікробіосенсорів більшої частини цих труднощів можна
уникнути, особливо, використовуючи диференціальну схему вимірювань, яка
дозволяє компенсувати зміну фонової провідності, вплив коливань температури та інші
фактори.
Кондуктометричний метод базується на
вимірюванні провідності розчинів електролітів. Для цього перш за все необхідно
заміряти активний опір між електродами, зануреними в досліджуваний розчин. Для
цього використовують мостову схему для вимірювань електричного опору, яку
вперше було розроблено Уітстоном, а Кольрауш її застосував для змінного струму [2, C. 373-396].
На рис. 1 приведено схему
вимірювань, в якій використано операційний підсилювач з високим опором.
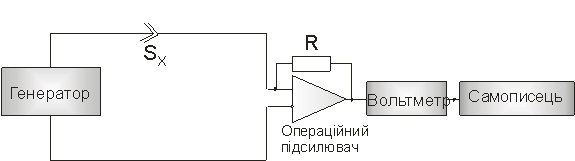
Рисунок 1- Схема кондуктометричної установки.
В цьому випадку провідність Sx
прямо пропорційна значенню струму на виході операційного підсилювача. Дану
схему взято за основу при вимірюваннях з ферментними кондуктометричними
біосенсорами в роботі.
Також можливо використовувати
чотирьох-електродну схему вимірювань. В цьому випадку струм пропускають через
одну пару електродів, а падіння напруги вимірюють за допомогою другої пари
електродів, що не поляризована струмом та відіграє роль зондів.
Література:
1. Aston. W.J., Ashby R.E. Higgins
I.J., Scott L.D. and Turner A.P.F. „Charge and field Effects in Biosystems”/ 1984. − P. 491-498.
2. Byfield M.P. and Abusknesha
R.A. Biochemical aspects of biosensors. Biosensors and Bioelectronics, 1996.
− Р. 373-396.
3. Дзядевич С.В. Клітинні та
ферментні Кондуктометричні біосенсори для визначення концентрацій деяких
субстратів та інгібіторів ферментів, 2004.
− C. 138 – 142.