MICROBIOLOGIA
Крисенко О.В., Скляр Т.В., Лобанова Ю.І., Вінніков А.І
Дніпропетровській національний університет ім. О.Гончара
ОСОБЛИВОСТІ АНТИБІОТИКОРЕЗИСТЕНТНОСТІ БАКТЕРІЙ РОДИНИ ENTEROBACTERIACEAE
Проблема
антибіотикорезистентності бактерій родини Enterobacteriaceae є досить актуальною в сучасній клінічній практиці, поширення яких лише
зростає по мірі вдосконалення медичних технологій. Водночас, інтенсивний
селективний натиск антибіотиків, обумовлює швидку еволюцію і поширення нових
механізмів резистентності серед штамів, що циркулюють у відділеннях
хірургічного профілю.
У етіологічній структурі хірургічних інфекцій
провідна роль належить грамнегативним мікроорганізмам. Саме при цих інфекціях
спостерігаються найбільші труднощі у виборі адекватного
режиму антибіотикотерапії, оскільки для збудників характерні множинні та
складні механізми резистентності, формування полірезистентності в процесі
проведення антибіотикотерапії. Проблема ускладнюється тим, що на
практиці не завжди вдається виявити резистентність in vitro, що призводить до
помилкових рекомендацій у виборі ефективного режиму терапії [1, 2].
Метою було дослідити
рівень та спектри стійкості до антибіотиків
бактерій родини Enterobacteriaceae.
Матеріали та методи дослідження.
Об’єктом дослідження були ізоляти ентеробактерій виділені від пацієнтів хірургічних відділень. Матеріалом для
дослідження було відокремлюване з раневих
поверхонь в разі виникнення післяопераційних ускладнень. Було проведено
виділення та ідентифікація мікроорганізмів, а
також визначення їх чутливості до антибіотиків.
Всього за 12 місяців
2012 року до лабораторії на дослідження надійшло 492 зразки патологічного матеріалу, з підозрою на
ураження викликане бактеріями, які було отримано з відділень хірургічного
профілю, у 297 з них було виявлено мікроорганізми.
Для визначення
резистентності використовували метод дисків [3]. Проводили визначення
резистентності до таких груп антибіотиків: пеніциліни –ампіциліни та
амоксіциклін; цефалоспорини – цефотаксим, цефтазідім та цефіпім; карбопенеми –
меропенем; аміноглікозиди – гентаміцин, амікацін та тоброміцин; фторхінолони
–ципрофлоксацин та норфлоксацин.
Результати
досліджень та їх обговорення. Всього за 12 місяців до лабораторії на
дослідження надійшло 492 зразки
патологічного матеріалу, які було отримано з хірургічних відділень. У 297 зразках
(70,5%) було виділено мікроорганізми, що викликали інфекційне ураження раневої поверхні. Встановлено, що присутні мікроорганізми наступних родин та родів: Enterobacteriaceae, Staphylococcus, Pseudomonas та
інші мікроорганізми, що не належали до досліджуваних
груп. При такому аналізі встановлено, що основним етіологічним фактором
післяопераційної ранової інфекції у 2012 р. були умовно-патогенні
ентеробактерії, які виявлено у 30,0 % матеріалу (88 зразків). З представлених даних можна заключити, що
найбільш широкий спектр збудників було виявлено у відділенні хірургії, що може
бути пояснено особливостями біотопу. Водночас слід відмітити переважання
мікроорганізмів родини Enterobacteriaceae
(Рис. 1)
над усіма
іншими, так, найбільш часто виявляли Escherichia coli (44,32%), дещо рідше – та Klebsiella pneumonia (12,5%), Morganella morganii (10,23%), Proteus mirabilis (5,67%), та 13,64– на долю інших збудників.
Найбільший рівень стійкості серед усіх ізолятів зафіксовано
до пеніцилінів (ампіцилін та амоксіцилін) від 77,9% до 85,7%. При цьому до
цефалоспоринів стійкими були від 50% (E.coli)
до 88,9% (E.cloacae).

Рисунок.1. Представники
бактерій родини Enterobactericeae,
виділені з раневих поверхонь.
Найефективнішим
антибіотиком виявився меропенем: стійкість відмічено лише серед ізолятів K.pneumoniae (18%
стійких) однак, це негативна ознака, так як до сьогодні карбапенеми вважалися
групою препаратів, проти якої мікроорганізми ще не мають стійкості (Рис
2).
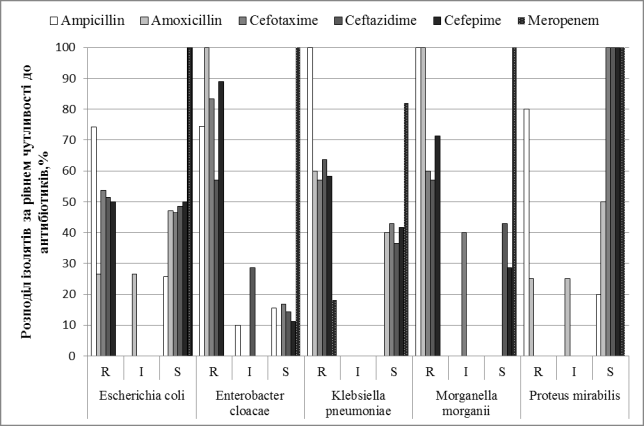
Рисунок 2. Розподіл
виділених ізолятів за рівнем чутливості до антибіотиків з груп пеніцилінів,
цефалоспоринів та карбапенемів.
Основними
механізмами стійкості до бета-лактамних антибіотиків у ентеробактерій є
продукція плазмідних і хромосомних бета-лактамаз, порушення проникності
зовнішньої мембрани, модифікація мішені пеніцилінз’вязуючих білків [4, 5, 6].
Слід відзначити, що
у літературних джерелах також відмічається резистентність ентеробактерій до цефалоспоринів
І-ІІІ та частково IV поколінь [7], які також можуть бути збудниками післяопераційних
ускладнень.
Наведені на Рис. 3 дані
свідчать, що ефективними виявилися аміноглікозидні антибіотики, з яких
протестовано гентаміцин, амікацин та тобраміцин.
Визначено, що найефективнішим серед аміноглікозидів був
амікацин – від 55% (K.pneumoniae) до 100% ізолятів (E.coli та P.mirabilis) були чутливими до нього.
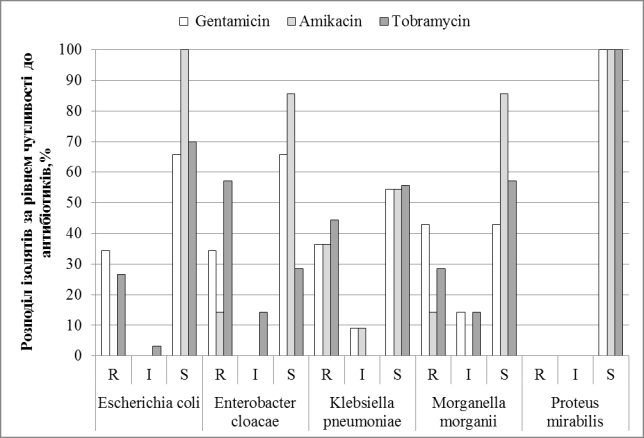
Рисунок 3. Розподіл
виділених ізолятів за рівнем чутливості до антибактеріальних препаратів з групи
аміноглікозидів.
Тобраміцин був менш активний по відношенню до E.cloacae – 57,1 %, K.pneumoniae – 44,4 % резистентних штамів, але 100% штамів P.mirabilis, 70% E.coli та 57,1 % ізолятів M.morganii були чутливими.
До гентаміцину серед дослідних штамів були чутливими від 55% (K.pneumoniae )до 100% ізолятів (P.mirabilis). Але серед штамів M.morganii 43% ізолятів були стійкими.
Основним механізмом
стійкості до аміноглікозидів є їхня інактивація шляхом модифікації.
Модифіковані молекули аміноглікозидів втрачають здатність зв'язуватися з
рибосомами й придушувати біосинтез білка [8].
Виділені штами
ентеробактерій виявили значну варіабельність щодо стійкості до фторхінолонів (Рис.
4). До ципрофлоксацину досліджені штами були
стійкими від 45% (K.pneumoniae) до
71% (M.morganii) ізолятів, але 60 %
штамів P.mirabilis були чутливими.
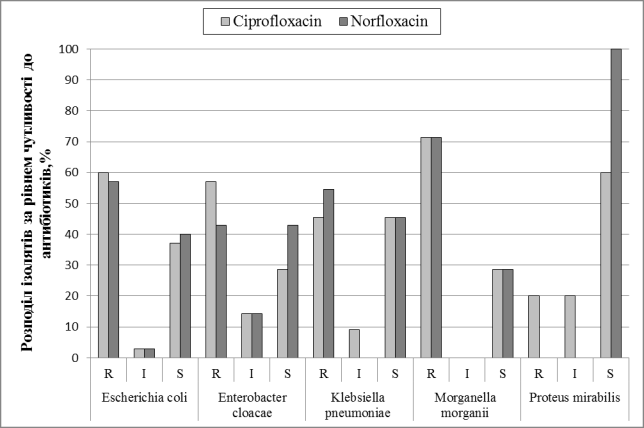
Рисунок 4. Розподіл виділених ізолятів за рівнем
чутливості до антибактеріальних препаратів з групи фторхінолонів
До норфлоксацину була
схожа стійкість, тільки серед штамів P.mirabilis
були чутливими 100% ізолятів.
Таким
чином, фторхінолони займають одне з провідних місць у терапії раневих інфекцій,
особливо тих, що спричинені грамнегативними мікроорганізмами. Вище ми вже
відмічали, що доля представників родини Enterobacteriaceae у етіології раневих інфекцій пацієнтів лікарняних стаціонарів
доволі висока (майже третина випадків), і проти них саме фторхінолони є одними
з найбільш дійових агентів [9]. Звичайно ж слід ураховувати протипоказання при
застосуванні (вагітність, порушення ниркової діяльності тощо), що зменшує
спектр пацієнтів [10], однак, при перевищенні терапевтичним ефектом ризиків та
при відсутності альтернативи можливе використання цих препаратів навіть у тих
випадках, до яких є протипоказання.
Висновок. Визначено, що найбільший відсоток стійких штамів ентеробактерій
був виявлений по відношенню до пеніцилінів (ампіцилін та амоксицилін) від 77,9 до 85,7%. При цьому до цефалоспоринів стійкими
були від 50% до 88,9%.
Встановлено, що найбільш чутливими ізоляти
були до карбопенемів (96,6 %), лише серед K.pneumonia 18% стійких ізолятів. По відношенню до аміноглікозидів
найбільша чутливість спостерігалась до амікацину (85%). Понад 65% ізолятів ентеробактерій
були чутливими до норфлоксацину.
Література:
1. Антибактериальная терапия. Практическое руководство / под редакцией Л.С.
Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – Москва: Б.и., 2000. – С. 27-39.
2. Белоусова С.Н. Антибактериальная терапия / С.Н. Белоусова,
Р.С. Козлов. – М.: Полимаг, 2000. – C. 190-198.
3. Наказ МОЗ України № 167 від 05.04.2007 «Про затвердження методичних
вказівок щодо визначення чутливості мікроорганізмів до антибактеріальних
препаратів». – К: МОЗ України, 2007. – 63 с.
4. Костюченко А.Л. Эмпирическая антимикробная химиопрофилактика и
химиотерапия у хирургического больного / А.Л. Костюченко // Анестезиология
и реаниматология. – 1999. – № 2. – С.45-48.
5.
Livermore D.M. β-lactamases in laboratory and clinical resistance / D.M. Livermore
// Clin Microbiol Rev. – 2005. – Vol. 8. – P. 557-584.
6.
Беляев А.В. Клиническое значение β-лактамаз расширенного спектра действия
//Клиническая антибиотикотерапия. – 2003. – №1. – С. 10-14.
7. Поздеев
О.К. Энтеробактерии: Руководство для врачей / О.К. Поздеев,
Р.В. Федоров. - М.: ГЭОТАР-Медиа, 2007. – 720с.
8.
Miller G.H. Nature and rate of aminoglycoside resistance mechanisms / G.H. Miller
// Clin. Drug Invest. – 1996. – Vol. 12, Suppl. 1. – P. 1-12.
9. Яковлев С.В. Место фторхинолонов
в лечении бактериальных инфекций / С.В. Яковлев // Лечащий врач. – 2008. – №2.
– С. 59-63.
10. Страчунский Л.С. Антибиотики: клиническая фармакология / Л.С. Страчунский,
С.Н. Козлов. – Смоленск: Град, 1994. – C. 208-254.