Аспетов ДР., Омарова
М.Н., Оракбай Л.Ж., Жуматова Б.Х
Научный центр гигиены и эпидемиологии им. Х.Жуматова
ВЛИЯНИЕ ПЕСТИЦИДА МЕТСУЛЬФУРОНМЕТИЛА НА ИНТЕРФЕРОНОБРАЗУЮЩУЮ ФУНКЦИЮ
КЛЕТОК ЧЕЛОВЕКА
В настоящее время пестициды относятся к одним из ведущих экзогенных загрязнителей биосферы. Несмотря на дозовые ограничения в применении, при попадании
остаточных количеств пестицидов в воду, почву, а также, учитывая
способность продуктов их разложения к кумуляции в окружающей среде, они представляют определенную угрозу для здоровья
человека [1,2,3 ]. Для населения, не связанного с производством пестицидов, их
потенциальная опасность
заключается, главным
образом, в употреблении продуктов
питания животного и растительного происхождения из агропромышленного производства. Широко применяемые в последние
годы пестициды – гербициды нового
поколения, используемые для уничтожения сорных растений и
кустарников, обладают ярко выраженным энзимопатическим эффектом
на ферменты растительных клеток [4,5]. Он заключается в инактивации
главных клеточных ферментов, отвечающих за рост и развитие
сорных растений. Отличительной особенностью новых гербицидов метсульфуронметила и глифосата является нечувствительность к ним генетически-модифицированных
культур. Что касается изучения механизма действия пестицидов на клетки животного происхождения, известно их токсическое действие на
активность важнейших клеточных ферментов животных, например, ацетилхолинэстеразы [6,7,8]. В то же
время действие пестицидов на факторы иммунной системы, в частности, на систему
интерферона еще недостаточно изучено.
В задачу исследований
входило изучение действия пестицида нового поколения метсульфуронметила на
функциональную способность
клеток человека RD к продукции защитного фактора
иммунитета - α/β- интерферона.
Материалы и методы.
Пестицид. Использован
пестицид метсульфуронметил (МСМ).- новыйпестицид гербицидного действия
(0,600 WG.2012-02-21 Polgar agrochem.Ltd.Herbicide;
Monitor WG). Применяли
растворы МСМ, приготовленные, ex
tempore, из сухих гранул на основе физиологического
раствора.
Клетки. В работе
использовали перевиваемую линию клеток
человека RD. Для выращивания клеток использовали пластиковые
флаконы емкостью 25см3 и
96-луночные пластиковые планшеты фирмы «BD Falcon»
в среде 199 с 10% фетальной сывороткой с посевной дозой со 2х105 кл/мл.
летки выращивали в термостате при
температуре 37°С, в атмосфере, содержащей
5% СО2.
Вирусы. В качестве индуктора
интерферона использовали – вирус болезни
Ньюкасла (ВБН). В качестве
индикаторного тест- вируса использовали вирус энцефаломиокардита мышей ЭМК в рабочей дозе 100 ТЦД50/мл (тканевых
цитопатогенных доз).
Интерферон. Определяли
микрометодом в 96-луночных пластиковых панелях За единицу активности интерферона
МЕ/мл принимали дозу, обратную его максимальному разведению, защищающему 50% клеток от цитопатогенного
действия (ЦПД50) вируса энцефаломиокардита мышей (ЭМК). В качестве контроля использовали референс
препарат ИФН для перевода полученной активности в международные единицы (МЕ) [
9,10 ].
Статистическую обработку данных проводили с применением программы Statistica. Различия считали достоверными при отличии от
контрольных значений на величину p< 0,05 [ 11
].
Результаты
Определение цитотоксических свойств пестицида метсульфурон-метила
( МСМ).
Минимальную концентрацию МСМ, не вызывающую 50% цитодеструкции клеток
(ЦД50)в течение 48 часов, определяли микрометодом в монослое
клеток RD. В 96-планшетах
выращивали суточный монослой, в который вносили последовательные концентрации
МСМ, начиная от 1:500 -0,5 мг (50 мкг/мл) до 1:32000. В контрольные клетки вносили
питательную среду, без МСМ. За
состоянием монослоя наблюдали в течение 72 часов. Через 12 часов контакта МСМ в концентрациях 1: 500 и 1: 1000 в клетках наблюдали дегенеративные изменения в виде округления
клеток, изменения рН среды в щелочную сторону, при отсутствии цитодеструкции в
контроле. За этот же период клетки в разведении 1:2000 монослой сохранялся на
50%. В клетках, дегенерации клеток
после 48 час контакта с МСМ в
разведениях от 1:4000 и далее до1: 32000 в течение 48 часов не наблюдалось. В
дальнейшем, для изучения способности клеток к продукции интерферона
использовали среднюю концентрацию МСМ 0,05 мг/мл.
Изучение
влияния времени контакта МСМ с клетками человека на продукцию – α/β интерферона.
На
сформировавшийся монослой клеток, выращенных
в 96 луночных пластиковых панелях вносили по 0,05 мг/мл МСМ в среде 199 с 10% фетальной сывороткой и помещали
в термостат при t 37°С в СО2
-камере на 24, 48, 72, 96 и 120
час, после чего среду, содержащую МСМ,
удаляли.
В монослой
вносили вирус-индуктор
интерферона- ВБН, клетки помещали в
термостат t 37°С на 24 часа, после чего культуральную среду собирали, подвергали соответствующей обработке и использовали для
определения активности α/β-интерферона.
Количество
интерферона определяли по его активности в подавлении цитопатогенного действия
(ЦПД50) тест вируса энцефаломиокардита мышей. Результаты определения
активности интерферона,
представленные на Рисунке 1, показали,
что уровень активности
α/β-интерферона снижался мере увеличения времени контакта клеток с МСМ – от 62±14,3 - через 24 часа
контакта до 12±1,5 МЕ/мл через 96 часов
экспозиции клеток с МСМ. Контрольные
клетки, не подвергшиеся воздействию МСМ за тот же период наблюдения
продуцировали ИФН с активностью от 260±2,3 до – 112,5 ±14,2 ед/мл). Клетки RD, обработанные МСМ
через 120 часов, полностью
утратили способность продуцировать интерферон.
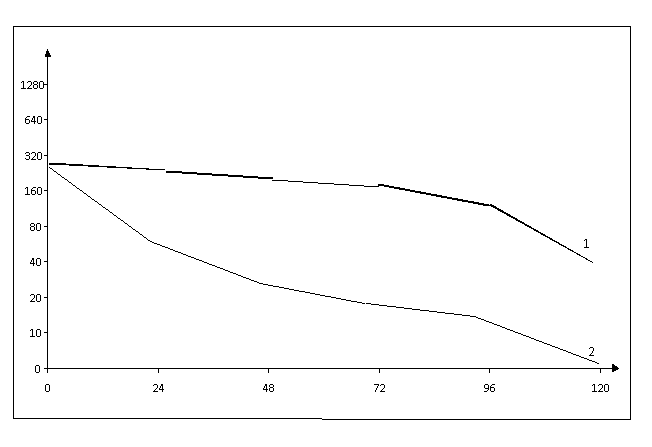

По оси абсцисс – время
контакта клеток с пестицидом метсульфуронметилом - линия 2
По оси ординат –
активность интерферона - линия 1
Рисунок 1 Продукция интерферона после контакта клеток RD с пестицидом метсульфуронметилом
Влияние
токсического действия низких доз новых пестицидов на факторы иммунитета мало
изучено. Нами показано действие пестицида нового поколения – метсульфуронметила, широко применяемого в с/хозяйственном
производстве, на выработку главного защитного
фактора иммунитета организма против инфекций – интерферона.
Результаты
представленных исследований показали,
что пестицид метсульфуронметил оказывал
ингибирующее влияние на продукцию α/β-интерферона перевиваемыми
клетками RD в концентрации, не вызывающей
цитотоксического действия. Подавление
продукции интерферона происхо- дит
происходило параллельно с увеличением времени контакта пестицида и с клетками.
Литература
1. Хамитова
Р.Я., Имамов А.А. Медико-экологические
аспекты химизации сельского хозяйства . – Казань, 2006.
2. Домшлак
М.Г., Макарова-Землянская Е.Н. // Медицина труда и промышленная экология –
2009. -№ 1. – С.45- 48.
3.Панина
Н.К. Лабораторный контроль за остаточным количеством пестицидов в окружающей
среде // Гигиена и санитария. -2010. -№ 3. – С 77-80.
4. Лохин К.Б. Гигиеническое обоснование регламентов безопасного применения гербицидов нового поколения на основе пестицида метсульфуронметила // Дисс. …канд.мед.наук. М. 2007).
5. Dianzani F. The Interferon system. Health Sciences Press.-
1993. – 435- 439.
6.Аширбеков Г.К., Сарсенбаева Ж.К., Ажиханова Г.Ж. Комбинированное действие различных классов пестицидов на организм // Актуальные вопросы формирования здорового образа жизни.-2009.- №4. – С.175-176;
7. Байзолданов
Т., Даулетбакова Ф,Д., Байзолданова Ш.Т. Токсикологическое значение пестицидов. Вестник Казахского Национального
медицинского униаерситета. - 2002. - №
2 (16). – С.152-156;
8. Гущин
Н.Б., Хайдарова Д.С., Кугушева Л.И. и др.
Активность ацетилхолинэстеразы лимфоцитов крыс при интоксикации пестицидам // Бюллетень экспериментальной биологии
и медицины. – 1991. – Т. 111, № 2. –
С.144 -146).
9. Ершов
Ф.И., Сайиткулов А.М. Микрометод для изучения индукторов интерферона in
vitro // Вопросы вирусологии. – 1984. –Том 29. - № 6 –С.756-
757).
10. Ершов
Ф.И. Система интерферона в норме и при патологии. – М.:1996;
11. Реброва О.Ю. Статистический анализ
медицинских данных. Применение пакета прикладных программ STATISTICA.
– М.,2006.