*119933*
Біологічні науки/5. Молекулярна біологія
Незелюк
О.І. 1, Кравчук І.В. 2,
Карпов О.В. 1, Телегеєв Г.Д. 2
Національний університет
харчових технологій, Київ, Україна1
Інститут молекулярної біології і генетики НАН
України2
Вивчення
доменної структури білка Bcr при Ph’-позитивних лейкеміях
В результаті реципрокної транслокації між 9 та 22 хромосомами утворюється
гібридна Ph’-хромосома, яка називається філадельфійською. Її наявність характерна для Ph’-позитивних
лейкемій. Результатом цієї хромосомної аберації є утворення гібридного гену bcr-abl,
експресія котрого призводить до злоякісної трансформації гемопоетичних клітин.
Переважна більшість попередніх робіт були спрямовані на вивчення активності
тирозинової кінази Abl-частини. Це дало змогу розробити і впровадити в клінічну
практику перший специфічний інгібітор тирозинової кінази, однак з’являється все
більше даних про виникнення мутацій, що перешкоджають дії цього лікарського
засобу. Таким чином, виникає проблема розробки нових специфічних агентів, як і
нових підходів до блокування сигнальних шляхів, у яких бере участь гібридний
білок Bcr-Abl.
Вплив частини Bcr на роль гібридного білка в пухлинній трансформації є
також досить істотною. Bін приймає участь в декількох важливих процесах
клітини: клатрін-залежний сигналінг з контролем сортувального комплексу,
контроль за активністю малих Rho
ГТФ-аз, зв’язування з компонентами актинового цитоскелету тощо. Функції Bcr забезпечуються різними його доменами, які мають сайти
зв’язування з різними білками клітини. Саме зв’язування з тими, чи іншими
білками різних структур клітини при втраті внаслідок мутацій певних доменних
компонентів може призводити до різної локалізації білка Bcr-Abl в клітині і
обумовлювати різницю в характері та пробігу захворювання.
Більш детальна характеристика доменів білка Bcr може допомогти як у
пошуку нових мішеней для лікарських препаратів, так і в з’ясуванні причин
розвитку певного фенотипу захворювання та механізмів його прогресії. В цьому
аспекті цікаво дослідити наявність РН домену білка Bcr-Abl на мембрані фагосоми
для оцінки перспективи терапії.
Метою даної
роботи є перевірка колокалізації
РН домена білка Bcr з мембраною фагосом методом
візуалізації фагосом за допомогою флуоресцентно мічених бактерій.
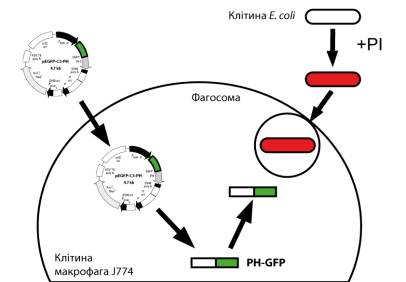
Рис. 1. Схема досліду.
Об’єктом дослідження була клітинна лінія мишачих макрофагів J774, які отримали із банку Інституту
молекулярної біології та генетики НАН України. Підтримували клітинну лінію
шляхом пересіву на чашки Петрі з середовищем DMEM (Dulbeco’s Modified Eagle’s
Medium) + 10% FВS (сироватка ембріона бика) та інкубували при температурі +37˚С та 5% СО2.
Плазмідний вектор pEGFP-C3
отримували з накопичувальної культури методом лужного лізису з
наступною трансформацією в компетентні клітини E.coli, для
напрацювання необхідної кількості. Очищення плазмідної ДНК проводили на
мембранних фільтрах.
Наступним етапом була рестрикція плазмідного вектора pEGFP-C3 з подальшим лігуванням . Рестрикцію вектора
проводили за допомогою ендонуклеаз BamHI
та HindII. Після отримання та
підготовки вставки (включаючи перевірку на відповідність її нуклеотидної
послідовності) та плазмідного вектора pEGFP-C3
було проведено лігування таким чином, щоб молярне співвідношення вектора до
вставки було 1:3, а також у присутності АТФ та ферменту – T4 ДНК лігази.
В результаті було отримано генетичну конструкцію pEGFP-С3-РH, яку перевіряли
на її відповідність розміру очікуваного фрагменту за допомогою ПЛР.
Електрофорез отриманого ПЛР-продукту проводили в 1%-му агарозному гелі.
За допомогою фарбування акридином оранжевим клітин E.coli можна побачити, що мишині макрофаги J774 поглинають бактерії шляхом фагоцитозу. Проте акридин оранжевий не підходить для наших
дослідженнь, оскільки дає зелений колір клітинам, що буде перекриватися з
РН-GFP (теж зелена флуоресценція).
Трансфекувати макрофаги планується конструкцією pEGFP-PH, а візуалізацію
фагосом проводити шляхом фарбування бактерій за допомогою флуоресцентного
фарбника. Як кандидати пропонується
бромістий етидій та пропідій йодид, що дають
червоний колір флуорисценції.
Клітини бактерій E.coli добре фарбуються бромистим
етидієм і пропідій йодидом. Оскільки
клітини E.coli мають дуже малі
розміри, що не дозволяє візуалізувати фагосому, тому використовували дріжджі S. сerevisiae, які мають більші розміри ніж бактерії E.coli, але менші ніж
макрофаги і також фарбуються пропідій йодидом.
Враховуючи те, що бромистий етидій фарбує дріжджі S. сerevisiae і
живі клітини макрофагів, то при додаванні пофарбованих ним дріжджів
відбувається зафарбовування цієї системи в один колір, що робить неможливим їх
розпізнавання, використання цього барвника є недоцільним. Саме тому в
дослідженні використовували пропідій йодид, який не фарбує живі макрофаги (за
рахунок непроникності через мембрану живої клітини).
Трансфекцію культури клітин мишачих
макрофагів J774 проводили з використанням ДЕАЕ-декстарну генетичною
конструкцією pEGFP-С3-РН, з якої буде синтезуватись білок РН-GFP. Цей білок
за рахунок вставки GFP (зелений флуоресцентний білок) дає зелене
забавлення при флуоресцентній мікроскопії, що дозволить виявити
колокалізацію РН домену з органелами клітини. Шляхом інкубування культури J774 з дріжджовими клітинами S. сerevisiae, які попередньо були пофарбовані пропідій йодидом,
здійснювали візуалізацію фагосом через 24 год після трансфекції. Макрофаги клітинної лінії J774 шляхом фагоцитозу поглинають
клітини S. сerevisiae,
що можна побачити на мікрофотографіях.

Рис.2. Мікрофотографія мишиних
макрофагів клітинної лінії J774 разом з дріжджовими клітинами S. сerevisiae,
що фарбувалися пропідій йодидом, в світлому полі (А) та в темному полі за умов
флуоресценції (В)
На фотографії у світлому полі (А) в центрі
бачимо макрофаг (він має більші розміри ніж інші клітини), який шляхом
фагоцитозу поглинає клітину S. сerevisiaе. Тоді як в темному полі за умов флуоресценції (В) відсутній, що
свідчить про те, що пропідій йодид не проникає в живі клітини макрофагів.
Через добу після трансфекування
перевіряли ефективність трансфекції шляхом флуоресцентної мікроскопії клітин макрофагів J774. Оскільки візуально у
мікроскоп було видно зелену флуоресценцію GFP-PH білка у більшості
трансфекованих клітин, близько 70%, то
трансфекцію можана вважати успішною. Але флуоресценція була дуже слабкою, що не
дозволяло зафіксувати її на камеру разом з програмою, яка стандартно
використовувалась для флуоресцентної мікроскопії у відділі. Це не дало
можливості встановити колокалізацію РН
домену білка Bcr з мембраною фагосоми, тому
у майбутньому буде здійснено спроби
пошуку можливих шляхів вирішення даної проблеми.