*120077*
Лапська Ю.Ю., Омельчук Є.О., Красінько
В.О., Чернюк Б.В.
Національний
університет харчових технологій, Київ, Україна
Сирчин С.О.
Інститут
мікробіології і вірусології ім. Д.К. Заболотного НАНУ, Київ, Україна
Оптимізація умов культивування Aspergillus sp. 262 та Corynascus sp. 2006 – продуцентів комплексу целюлолітичних ферментів
Вступ.
Целюлази
належать до групи гідролітичних ферментів, які здатні до гідролізу
найпоширенішого органічного полімеру – целюлози. Інтерес до них постійно росте
завдяки великому потенціалу їх використання в сільському господарстві, а також
у ряді інших галузей промисловості. Відомо, що глибокий гідроліз целюлози
здійснюється в результаті узгодженої дії поліферментної системи, яка
складається з трьох ключових ферментів: ендо-β-1,4-глюканази
(КФ 3.2.1.4), екзо-β-1,4-глюканази або
целобіогідролази (КФ 3.2.1.91), целобіази або β-глюкозидази
(КФ
3.2.1.21). Кількість індивідуальних целюлолітичних ферментів, а також їх різні
форми, що входять до складу целюлазного комплексу, різна і залежить від
особливостей мікроорганізму-продуцента.
Використання целюлозолітичних ферментів
або мікроорганізмів, здатних асимілювати целюлозовмісну сировину, отримуючи з
неї енергію, дає можливість здійснювати біоконверсію целюлози у глюкозу,
целобіозу і ксилозу. Дані продукти представляють великий інтерес як сировина
для подальшої переробки її в біоетанол та інші спирти, амінокислоти,
антибіотики, білкову біомасу тощо.
На сьогодні ферментні препарати на основі
целюлаз широко використовуються у тваринництві та птахівництві як добавки до
кормів для підвищення їх поживної цінності, а також для збереження
продуктивності тварин та підвищення їх імунітету. Раціональне використання
ферментних препаратів в процесі приготування кормів призводить до прискореного накопичення
низькомолекулярних продуктів у шлунково-кишковому тракті тварин, що сприяє
розвитку індогенної мікрофлори, інтенсифікації процесів мікробної ферментації
кормів і прискореному росту та розвитку тварин.
На сьогодні найбільш поширеним видом
целюлозовмісної сировини є відходи переробної промисловості та сільського
господарства. Тому відходи, які втратили свої споживчі властивості і не можуть
бути використані за прямим призначенням через технологічні особливості
підприємства, можуть бути використані як недорогі субстрати в технологіях
одержання ферментів целюлолітичного комплексу.
У
зв'язку із зростанням попиту на ферменти целюлолітичного комплексу в різних
галузях промисловості актуальною стала потреба в розробленні нових та
удосконаленні вже існуючих технологій їх виробництва. Одним із важливих засобів
інтенсифікації їх біосинтезу є підбір оптимальних умов культивування
продуцентів целюлаз, що і було метою дослідження.
Матеріали і методи. Об’єктами
дослідження були штами термотолерантних мікроскопічних грибів Aspergillus sp. 262 та Corynascus sp. 2006, відібраних з колекції мікроорганізмів відділу фізіології та систематики
мікроміцетів Інституту мікробіології і вірусології НАН України.
Культивування здійснювали на поживних
середовищах, склад яких підібраний для максимального біосинтезу комплексу
целюлолітичних ферментів. Для культивування Aspergillus
sp. 262 використовували поживне середовище такого складу, г/л: буряковий
жом – 20, сечовина – 1,56, Na2HPO4·12H2О – 2,6, KCl
– 0,5, MgSO4·7Н2О – 0,5, FeSO4·7Н2О
– 0,01; для Corynascus sp 2006, г/л:
вівсяна солома – 20, NH4NO3 – 2, NaH2PO4 – 1, KCl –
0,5, MgSO4·7Н2О – 0,5, FeSO4·7Н2О –
0,01.
Культивування інокуляту здійснювали на
поживному середовищі аналогічного складу протягом 1, 2, 3, 4 та 5 діб. Посівний
матеріал у колби вносили в кількості 5, 10, 15% до об’єму поживного середовища.
Для встановлення оптимальних умов синтезу
ферментів целюлаз штами Aspergillus sp.
262 та Corynascus sp 2006 вирощували
у колбах Ерленмейєра (750 мл) з об’ємом поживного середовища 100, 150 та 200
мл, за швидкості обертання качалки 160 і 220 об/хв і температури 20, 28 та
42°С.
Динаміку накопичення ферментів,
загального білку та зміну рН у культуральній рідині визначали кожні 12 годин
протягом 144 годин повного терміну культивування.
Вміст загального білку визначали за
допомогою методу Лоурі.
Активність ендоглюканази
(СMС) визначали віскозиметрично за допомогою
віскозиметра Освальда за зниженням в’язкості 0,3%-вого розчину Na-КМЦ.
Екзоглюканазну
активність (FPA) визначали за адаптованою методикою Мандельса і
Вебера, щодо мікроміцетів як об’єктів дослідження, засновану на принципі
відновлення редукуючих цукрів, з використанням гексоціаноферату калію.
Результати та обговорення.
Визначено, що оптимальними умовами підготування посівного матеріалу для
культивування штамів Aspergillus sp.
262 та Corynascus sp. 2006 є внесення
в середовище 10% трьохдобової культури.
На основі експериментальних даних було встановлено, що для культивування
штамів Aspergillus sp. 262 та Corynascus sp. 2006 з метою одержання максимального біосинтезу целюлаз
оптимальними є такі технологічні параметри: частота перемішування – 220 об/хв
для Aspergillus sp. 262 та 160 об/хв
для Corynascus sp. 2006 відповідно,
температура культивування – 42ºС, об'єм поживного середовища 150 мл для Aspergillus sp. 262 та 200 мл для Corynascus sp. 2006.
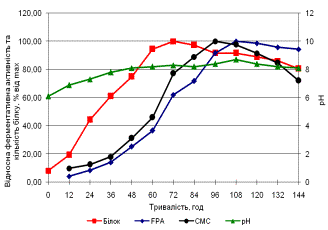
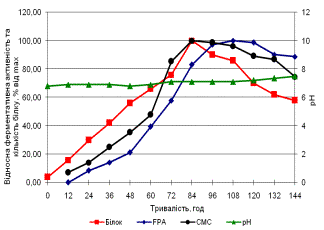
В процесі дослідження динаміки біосинтезу
целюлолітичних ферментів Aspergillus sp.
262 визначено, що максимум ендоглюканазної активності припадає на 96 годину
культивування, екзоглюканазної – на 108 годину. Максимум ендоглюканазної
активності Corynascus sp. 2006
припадає на 84 годину, екзоглюканазної – на 108 годину. Оптимальним часом
культивування для Aspergillus sp. 262
та Corynascus sp. 2006 є 96 годин
(рис.).
|
|
|
|
а |
б |
Рис. Динаміка біосинтезу целюлолітичних
ферментів Aspergillus sp. 262 (а) та Corynascus sp. 2006 (б)
У процесі оптимізації умов культивування
ендоглюканазна активність була підвищена у 8,2 рази, екзоглюканазна – у 5
разів.