*119867*
Химия и химические технологии/7. Неорганическая химия
Д.х.н., профессор Рустембеков К.Т., к.х.н., доцент Дюсекеева
А.Т.,
к.х.н.
Рустембекова Г.К., Әтем К.Б., Ашеева А.А.
Карагандинский
государственный университет им. Е.А.
Букетова,
Республика Казахстан
Теплоемкость
и термодинамические функции селената натрия-кадмия в интервале 298,15-673 К
Термодинамические и термохимические
свойства соединений представляют определенный интерес для моделирования
технологического процесса получения веществ с заданными свойствами [1, 2]. В этом плане изучение системы, состоящей из оксидов s-d-металлов и селена, имеют большое значение для
неорганического материаловедения и образующиеся в них новые селенаты могут
обладать одновременно оригинальными и уникальными свойствами.
Цель данной работы – исследование
теплоемкости и термодинамических свойств селената натрия-кадмия. Исходными
компонентами для синтеза двойного селената служили карбонаты натрия, кадмия и
68%-ная селеновая кислота марок «х.ч.» в стехиометрическом соотношении.
Методика синтеза аналогична, приведенная в работе [3]. Образование равновесного
состава и индивидуальность соединения контролировали методами рентгенофазового
и химического анализов. Синтезирован селенат натрия-кадмия - Na2Cd(SeO4)2.
Теплоемкость синтезированного соединения
исследовали методом динамической калориметрии на серийном приборе ИТ-С-400 в
интервале температур 298,15 – 673 К. При каждой температуре для усредненных
значений удельной теплоемкости проводили оценку среднеквадратичного отклонения ![]() , а для мольной теплоемкости вычисляли случайную составляющую
погрешности
, а для мольной теплоемкости вычисляли случайную составляющую
погрешности ![]() .
.
Работа калориметра
проверена при определении теплоемкости ![]() . Полученное значение
. Полученное значение ![]() (298,15)
(298,15) ![]() , равное 76,0 Дж/(моль·К), удовлетворительно согласуется с
его рекомендованной величиной 79,0 Дж/(моль·К). Эти данные показывают
достоверность полученных результатов.
, равное 76,0 Дж/(моль·К), удовлетворительно согласуется с
его рекомендованной величиной 79,0 Дж/(моль·К). Эти данные показывают
достоверность полученных результатов.
Исследованы удельные теплоемкости селената
- Na2Cd(SeО4)2,
затем из полученных экспериментальных значений были рассчитаны его мольные
теплоемкости (табл. 1). Из результатов, приведенных в таблице 1, видно, что во
всем температурном интервале погрешности измерения теплоемкости укладываются в
пределы погрешности прибора ИТ-С-400 (±10%).
Таблица 1
Экспериментальные
данные по удельной и мольной теплоемкостям Na2Cd(SeО4)2
|
Т,
К |
|
|
|
298,15 |
0,3684±0,0130 |
164±16 |
|
323 |
0,5143±0,0081 |
229±10 |
|
348 |
0,6317±0,0069 |
281±9 |
|
373 |
0,7472±0,0084 |
332±10 |
|
398 |
0,8070±0,0102 |
359±13 |
|
423 |
0,8654±0,0033 |
385±4 |
|
448 |
0,7921±0,0085 |
352±10 |
|
473 |
0,7199±0,0076 |
320±9 |
|
498 |
0,6752±0,0076 |
300±9 |
|
523 |
0,6155±0,0077 |
273±10 |
|
548 |
0,6055±0,0077 |
291±4 |
|
573 |
0,5627±0,0078 |
307±4 |
|
598 |
0,5428±0,0077 |
330±4 |
|
623 |
0,5865±0,0099 |
345±4 |
|
648 |
0,6415±0,0089 |
355±4 |
|
673 |
0,6668±0,0041 |
363±5 |
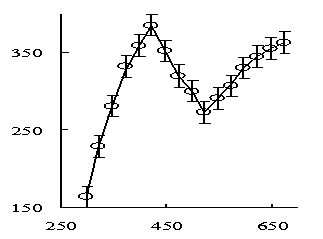
При исследовании
зависимости теплоемкости Na2Cd(SeО4)2 от температуры при 423 К
обнаружен резкий аномальный скачок, связанный, вероятно, с фазовым переходом II
рода (рис. 1). Этот переход может быть связан с катионными перераспределениями,
с изменениями коэффициента термического расширения и изменениями магнитных
моментов синтезированного соединения.
|
Т, К |
Рисунок 1 - Температурная
зависимость теплоемкости селената натрия-кадмия в интервале 298,15 – 673 К
По экспериментальным данным выведены
уравнения температурной зависимости теплоемкости [Дж/(моль·К)]:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
На основании известных соотношений и
значений коэффициентов из уравнений температурной зависимости теплоемкости
рассматриваемого соединения были рассчитаны термодинамические функции ![]() ,
, ![]() и
и ![]() (табл. 2). Для всех
значений теплоемкости и энтальпии во всем интервале температур оценили средние
случайные составляющие погрешности, а для значений энтропии и приведенного
термодинамического потенциала в оценку погрешности включили точность расчета
энтропии (±3%). Значения стандартных энтропий были оценены методом ионных
энтропийных инкрементов Кумока [4].
(табл. 2). Для всех
значений теплоемкости и энтальпии во всем интервале температур оценили средние
случайные составляющие погрешности, а для значений энтропии и приведенного
термодинамического потенциала в оценку погрешности включили точность расчета
энтропии (±3%). Значения стандартных энтропий были оценены методом ионных
энтропийных инкрементов Кумока [4].
Таблица 2
Термодинамические
функции Na2Cd(SeО4)2 в интервале 298,15-673 К
|
Т, К |
Дж/(моль·К) |
Дж/(моль·К) |
|
|
|
298,15 |
164±5 |
290±17 |
- |
290±17 |
|
300 |
170±5 |
291±17 |
333±10 |
290±17 |
|
325 |
234±7 |
307±18 |
5404±155 |
290±17 |
|
350 |
284±8 |
326±19 |
11900±340 |
292±17 |
|
375 |
325±9 |
347±20 |
19538±559 |
295±17 |
|
400 |
359±10 |
369±22 |
28102±804 |
299±18 |
|
425 |
387±11 |
392±23 |
37429±1070 |
304±18 |
|
450 |
355±10 |
413±24 |
46642±1334 |
309±18 |
|
475 |
327±9 |
431±25 |
55160±1578 |
315±18 |
|
500 |
299±9 |
447±26 |
62985±1801 |
322±19 |
|
525 |
271±8 |
461±27 |
70115±2005 |
328±19 |
|
550 |
298±9 |
474±28 |
77286±2210 |
334±20 |
|
575 |
318±9 |
488±29 |
84963±2430 |
341±20 |
|
600 |
338±10 |
502±29 |
93061±2662 |
347±20 |
|
625 |
350±10 |
516±30 |
101509±2903 |
354±21 |
|
650 |
361±10 |
530±31 |
110248±3153 |
360±21 |
|
675 |
372±11 |
543±32 |
119225±3410 |
367±22 |
Таким образом, впервые
методом динамической калориметрии в интервале 298,15 – 673 К исследованы
изобарные теплоемкости синтезированного селената натрия-кадмия на основе
которых выведены уравнения зависимости С0р ~ f(Т).
Наличие фазового перехода II рода на температурной кривой теплоемкости дает
возможность предположить о том, что данное соединение может обладать
уникальными электрофизическими свойствами.
На основе экспериментальных данных по С0р ~ f(Т)
и вычисленных значений ![]() двойного селената
определены температурные зависимости термодинамических функций
двойного селената
определены температурные зависимости термодинамических функций ![]() ,
, ![]() и
и ![]() . Термодинамические характеристики селената натрия-кадмия
являются исходными материалами для включения в фундаментальные банки данных и
справочники, могут быть использованы для прогнозирования термохимических
констант аналогичных соединений, направленного синтеза веществ с ценными
физико-химическими свойствами.
. Термодинамические характеристики селената натрия-кадмия
являются исходными материалами для включения в фундаментальные банки данных и
справочники, могут быть использованы для прогнозирования термохимических
констант аналогичных соединений, направленного синтеза веществ с ценными
физико-химическими свойствами.
Литература:
1. Резницкий Л.А. Калориметрия твердого тела. - М.:
Изд-во МГУ, 1981. – 183 с.
2. Резницкий Л.А. Исследование метастабильных состояний
калориметрическими методами // Итоги науки и техники: Химическая термодинамика
и равновесия. – М.: ВИНИТИ. Вып.4. – 1978. – 43 с.
3. Рустембеков К.Т.,
Дюсекеева А.Т. Синтез, рентгенография и ИК-спектроскопия Na2Cd(SeO4)2
// Вестник КарГУ им. Е.А.Букетова. Серия Химия. – 2007. – №3(47). – C. 72 – 74.
4. Кумок В.Н. Проблема согласования методов оценки
термодинамических констант // Прямые и обратные задачи химической термодинамики.
– Новосибирск: Наука, 1987. – С. 108 – 123.