Акимбаева А.К., к.б.н., ассистент, Кухар Е.В., к.в.н., доцент
Казахский агротехнический университет им. С.Сейфуллина
г. Астана, Республика Казахстан
ДИАГНОСТИЧЕСКАЯ ЦЕННОСТЬ
МКА ПРИ ВЫЯВЛЕНИИ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ РУБРОМИКОЗА
В Казахстане из-за нарушения экологического равновесия,
некорректного применения антибиотиков и других лекарственных препаратов широкое
распространение среди населения получили дерматомикозы различной локализации. В
экологически неблагополучных районах Казахстана отмечается все более
расширяющийся спектр микромицетов – возбудителей заболеваний различной
локализации за счет «факультативных паразитов», «сапрофитов», «фитопаразитов» и
др., что объясняется как их изменчивостью под влиянием антропогенного
воздействия, так и снижением иммунитета у населения [1].
Руброфитии, связанные с поражением ногтей
(онихомикозы), распространены среди всех групп населения, особенно среди
пожилых людей старше 60 лет. Но в последнее время увеличивается заболеваемость
грибковыми инфекциями у детей [2].
Установлено, что наиболее распространенными
являются микозы, вызванные дерматофитами рода Trichophyton rubrum (50,2%). Кроме того выявлено большое разнообразие клинической картины дерматомикозов,
вызываемых T. rubrum [3].
Диагностические
препараты для установления дерматомикозов в Казахстане отсутствуют,
микологические исследования проводятся в течение длительного периода времени.
При этом, достоверность положительных результатов при выделении чистой культуры
достигает 36% [3, 4].
Целью наших исследований явилось сравнение диагностической
ценности разработанной нами иммуноферментной тест-системы с регламентированными
методами диагностики дерматомикозов, применяемыми в повседневной лабораторной
микологической практике.
Материалы
и методы
В работе использовали антиген
дерматомицета T. rubrum,
полученный по методу L. Tabatabai
(1979) [5].
При
постановке реакции агглютинации (РА), непрямого и «сэндвич» варианта ИФА в
качестве положительного контроля использовали сыворотку больного К., 1941 г. р.
с диагнозом «микоз стоп и онихомикоз ногтевой пластинки большого пальца левой
стопы», подтвержденный культуральной диагностикой, с титром антител в непрямом
ИФА – 1:6400 и в РМА – 1:256.
В качестве отрицательного
контроля использовали пул сывороток здоровых людей с отсутствием специфических
антител к возбудителю рубромикоза, протестированных ранее в РМА, непрямом и
«сэндвич» варианте ИФА. Для контроля явления самоагглютинации применяли
забуференный физиологический раствор при рН 7,2.
Результаты работы
При создании иммуноферментной тест-системы
были отработаны параметры постановки реакции, включающие определение
оптимальной концентрации, объёма, температуры и времени инкубации используемых
реагентов. В ходе исследований установлено, что принципиальной разницы между продолжительностью
сенсибилизации антигена не существует. При инкубации планшета в течение 2 часов
при температуре 37° С и в течение 16-18 часов при температуре 4-5° С получены практически аналогичные результаты: 1,604
± 0,39 и 1,528 ± 0,84, соответственно.
При
подборе оптимальной концентрации антигена в лунки 96-луночного планшета его
вносили в концентрации 5, 10, 15, 20, 25, 30
мкг/мл.
В ходе
работы установлено, что оптимальной является концентрация антигена 10 мкг/мл,
т.к. это позволяет
выявлять титры антител у людей и лабораторных животных до 1:12800 с показателем ОП до 1,200-2,102.
Подобные показатели выявлены и при использовании антигена в концентрациях 15-30 мкг/мл с той лишь разницей, что при
употреблении антигена в концентрации 30 мкг/мл показатель ОП увеличивается до
2,848. Следовательно, использование антигена в концентрации 10 мкг/мл позволяет
учитывать реакцию в среднестатистических параметрах, а увеличение концентрации
антигена является нерациональным, т.к. увеличивается расход компонентов реакции
при тех же показателях (таблица 1).
Таблица 1 – Расчет оптимальной концентрации
антигена
при n = 3
|
Концентрация антигена |
Показатели выявленных титров антител в сыворотках крови иммунизированных мышей |
М± m |
||||
|
1 |
2 |
3 |
||||
|
5
мкг/мл |
1:3200 |
1:800 |
1:3200 |
1:2 400 |
± |
0,68 |
|
10
мкг/мл |
1:12800 |
1:25600 |
1:25600 |
1:21333 |
± |
0,34 |
|
15
мкг/мл |
1:3200 |
1:1600 |
1:12800 |
1:5870 |
± |
1,02 |
|
20
мкг/мл |
1:12800 |
1:6400 |
1:12800 |
1:10667 |
± |
0,34 |
|
25
мкг/мл |
1:1600 |
1:25600 |
1:12800 |
1:13333 |
± |
1,37 |
|
30
мкг/мл |
1:12800 |
1:12800 |
1:25600 |
1:17067 |
± |
0,34 |
Оптимальное разведение МКА для постановки
сэндвич варианта ИФА с целью выявления специфических антител определяли
следующим образом: в лунки 96-луночного планшета вносили по 50 мкл белкового антигена T. rubrum. После инкубации антигена и
1% БСА вносили МКА в разведении с 1:100
до 1:6400. После инкубации в течение 1 часа при 37° С вносили конъюгат.
Антитела против структурных белков дерматомицета определяли количественно по
расщеплению субстрата на спектрофотометре. В результате установлено, что
наименьшее разведение МКА для постановки ИФА – 1:1600 ± 0,67, оптимальное разведение
МКА – 1:400.
Для определения титра антител против
возбудителя рубромикоза в сыворотках крови людей нами отрабатывался сэндвич
вариант ИФА на основе МКА, который ставили на планшете (рисунок 1).
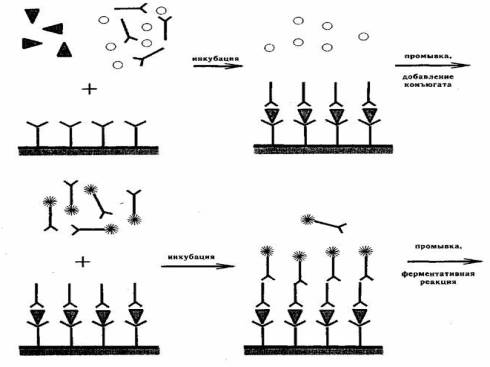
На
рисунке отмечены следующие обозначения:
![]() - МКА к белковому антигену гриба T. rubrum, иммобилизированные на твердой фазе
- МКА к белковому антигену гриба T. rubrum, иммобилизированные на твердой фазе
![]() - несвязавшиеся вещества исследуемой
сыворотки
- несвязавшиеся вещества исследуемой
сыворотки
![]() - белковый антиген
- белковый антиген
![]() - антивидовой конъюгат
- антивидовой конъюгат
![]() - специфическое антитело исследуемой
сыворотки
- специфическое антитело исследуемой
сыворотки
Рисунок 1 – Схема постановки ИФА для диагностики
рубромикоза
Анализ сывороток крови пациентов на
предмет выявления антител к возбудителю рубромикоза проводили методом
иммуноферментного анализа (непрямой и сэндвич-вариант с использованием
моноклональных антител (МКА) штамма гибридомы Mab/Тr 1 – 3С10 к белковому антигену Trichophyton rubrum) и
реакцией агглютинации в микроварианте (РМА) с корпускулярным антигеном T. rubrum. Сыворотки крови тестировались на наличие
специфических антител в трехкратном повторе.
Контроль
результатов иммуноферментного анализа проводили проведением микроскопии,
выделением чистой культуры и постановкой реакции агглютинации в микроварианте
(РМА).
Согласно результатам клинического
обследования больных специалистами-дерматологами у группы обследованных
выявлены хорошо отграниченные очаги поражения округлой и овальной очертаний в
паховой области и внутренней части бёдер. Периферическая зона окружена
гиперемированным бордюром из мелких узелков, пузырьков и корочек. Поставлены
диагнозы: трихофития
гладкой кожи, паховая трихофития и рубромикоз.
При микроскопическом исследовании во всех
пробах обнаружен мицелий гриба. При культуральном исследовании во всех пробах
рост дерматомицетов не наблюдали в течение всего периода наблюдения (30 дней).
Для выявления специфических антител к
возбудителю руброфитии проводили отбор крови в вакутейнеры, сыворотку
исследовали в РМА и ИФА. Результаты анализа клинической картины заболевания,
лабораторных исследований патматериала и серологического тестирования сывороток
крови пациентов в сравнительном аспекте на предмет выявления возбудителя
рубромикоза или антител к нему отражены в таблице 2.
Таблица 2 – Сравнительные результаты клинических и
лабораторных исследований при диагностике рубромикоза
|
№ п/п |
Клиническое исследование |
Микроскопия |
Культуральное исследование |
РМА |
непрямой вариант ИФА |
«сэндвич» вариант ИФА |
|
1 |
Трихофития гладкой кожи |
Обнаружен мицелий гриба |
роста нет |
РО |
1:3200 |
1:200 |
|
2 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
1:4 |
1:12800 |
1:3200 |
|
3 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
РО |
1:1600 |
РО |
|
4 |
Трихофития гладкой кожи |
Обнаружен мицелий гриба |
роста нет |
1:2 |
1:3200 |
1:400 |
|
5 |
Паховая трихофития |
Обнаружен мицелий гриба |
роста нет |
1:2 |
1:1600 |
1:400 |
|
6 |
Трихофития гладкой кожи |
Обнаружен мицелий гриба |
роста нет |
1:2 |
1:1600 |
1:100 |
|
7 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
РО |
1:6400 |
1:800 |
|
8 |
Паховая трихофития |
Обнаружен мицелий гриба |
роста нет |
РО |
1:3200 |
1:400 |
|
9 |
Трихофития гладкой кожи |
Обнаружен мицелий гриба |
роста нет |
1:8 |
1:12800 |
1:3200 |
|
10 |
Паховая трихофития |
Обнаружен мицелий гриба |
роста нет |
РО |
1:6400 |
1:400 |
|
11 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
РО |
1:1600 |
1:400 |
|
12 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
1:256 |
1:3200 |
1:12800 |
|
13 |
Глубокая трихофития гладкой кожи |
Обнаружен мицелий гриба |
роста нет |
1:8 |
1:800 |
1:6400 |
|
14 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
1:16 |
1:800 |
1:3200 |
|
15 |
Рубромикоз |
Обнаружен мицелий гриба |
роста нет |
1:4 |
1:3200 |
1:800 |
Примечание: РО – реакция отрицательная.
Как видно из таблицы 2, по результатам
клинических диагностических исследований из 15 исследованных 7 проб (47%) были
определены как положительные на рубромикоз. Микроскопия позволила выявить
мицелий в пробах материала в 15 пробах (100%),
однако возбудитель не идентифицирован до вида и рода. При бактериологическом
исследовании рост дерматомицетов отсутствовал. Это объясняется тем, что (со
слов врачей и самих пациентов) все обследованные до обращения за
специализированной медицинской помощью самостоятельно лечились фунгицидными
препаратами или, при назначении препаратов специалистами частных медицинских
центров, принимали противопаразитарную терапию парентерально и наружно, что и
отразилось впоследствии на результатах культуральных исследований.
При тестировании сывороток крови пациентов
в непрямом варианте ИФА, «сэндвич» варианте ИФА с использованием МКА и РМА
выявлено положительных: в РМА – 4 пробы, в непрямом варианте ИФА – 15, и в «сэндвич» варианте ИФА – 12
проб.
В РМА положительных проб было выявлено
15%, что говорит о низкой специфичности данной реакции. В непрямом варианте ИФА
все исследуемые пробы показали положительный результат (100%). Недостаточную
специфичность непрямого варианта ИФА может объяснить тот факт, что в
исследуемых пробах сывороток присутствуют антитела к близкородственному виду
дерматомицета, так как дерматофиты
содержат в своем составе несколько полисахаридных компонентов, общих для всех
грибов, а также имеют большое количество группо- и родоспецифических антигенов.
При использовании МКА, полученных к одной
детерминанте антигена Т. rubrum, в
ИФА выявлено 80% положительных результатов.
Совпадение положительных результатов в
«сэндвич» варианте ИФА и при клиническом обследовании обнаружено в 6 образцах
проб, но в ИФА выявлено положительных результатов в два раза больше.
Объясняется это тем, что характерные клинические признаки проявляются только
при генерализованной или хронической форме течения болезни. В ИФА антитела к
возбудителю заболевания улавливаются уже на начальных этапах заражения.
Считаем, что в пробах №9 и №13 также следует уточнять диагноз, т.к. здесь возможны врачебные ошибки. Результаты иммуноферментного анализа с применением тест-системы на основе моноклональных антител, которая является высокоспецифичной, свидетельствуют о процессе, вызванном Т. rubrum. Этот вывод подтверждают также результаты реакции агглютинации и непрямого варианта ИФА.
Результаты
исследований позволяют установить диагностический титр для разработанного нами
сэндвич-варианта иммуноферментного анализа.
Учитывая
особенности строения клеточной стенки дерматомицетов и наличие слабо выраженных
перекрестных реакций, титр антител 1:400 считать свидетельствующим о возможном
заражении Т. rubrum или
родственными видами дерматомицетов и принимать за сомнительный результат. При
выявлении титра антител 1:400 и ниже, рекомендуем наблюдение за данными
показателями в динамике через 14 – 28 суток и повторное выделение чистой
культуры. Титр антител к возбудителю руброфитии равный 1:800, считаем
диагностическим, который указывает на явное заражение Т. rubrum. Титр антител 1:100 и ниже не учитывать как
положительный результат и принимать за показатели фона.
Во
всех случаях при получении слабоположительных результатов 1:200-1:400
рекомендуем проведение культуральной диагностики и тщательный анализ результатов
на наличие оппортунистической микрофлоры.
Таким образом, нами отработаны параметры ИФА с
использованием МКА для выявления антигенов в патматериале и специфических
антител в сыворотке крови людей к Т. rubrum.
Специфические антитела к Т. rubrum
выявляются в сыворотке крови при её разведении до 1:12800, антигены
дерматомицета выявляются в патматериале с помощью непрямого варианта ИФА
(качественная реакция) и в сэндвич варианте ИФА.
Полученные данные свидетельствуют о возможности
использования МКА штамма гибридомы Mab/Тr 1 – 3С10 в качестве
реагента при разработке иммуноферментных тест-систем, которые позволят значительно усовершенствовать методы
лабораторной диагностики дерматомикозов человека, вызванных Т. rubrum.
Использованная литература
1
Фадеева Л.М., Бызова
З.М., Айдарханова Г.С. Микроскопические грибы и их реакция на изменяющиеся
экологические условия // Ядерно-физические методы и их возможности применения в
биологии и агроэкологии. – Алматы, 1999. – С. 56-57.
2
Карибаева А.Т.
Клинико-эпидемиологические особенности дерматомикоза, обусловленного Тriсhорhуtоn violaceum //
Проблемы медицинской микологии. – 2008. – Т. 10, №2. –
С. 68.
3 Pierard G.
Onychomycosis and other superficial fungal infections of the foot in the
elderly a pan-European survey // Dermatology. – 2001. – Р. 202, 220-224.
4
Умбетьярова Л.Б. Детская
проблема г. Алматы. // Успехи медицинской микологии. – 2004. – № 4. – С. 21-22.
5 Сұраншиев Ж.Ә. Brucella-ның сыртқы мембрана белоктарын сиыр бруцеллезін балауда қолдану. Вет. ғыл. кан. ... авторефераты. – Астана, 2003. –25 б.