Химия и химические технологии/7.Неорганическая химия.
Студентка
4 курса Хацринова Ю.А., д.т.н., проф. Хацринов А.И.
Казанский национально исследовательский технологический
университет, Россия
Разделение соединений кобальта и
молибдена
Соединения
кобальта и молибдена, в частности, их оксиды применяются во многих отраслях
промышленности: химической, нефтехимической, металлургической и в
машиностроении. Кобальт и молибденсодержащие катализаторы широко используются в
нефтехимической и химической технологиях для проведения процессов гидрирования,
гидрокрекинга, оксосинтеза и многих других процессов. Остатки и отходы таких
химических производств в большинстве случаев содержат небольшие количества
кобальта и значительные количества органических веществ, и составляют десятки
тысяч тонн в год [1].
Возможность
утилизации остатков позволит существенно снизить количество отходов, улучшить
экологию промышленных районов, а также вернуть в технологические циклы ценные
соединения кобальта и молибдена. Для этого необходимо разработать способ
разделения кобальта и молибдена для использования в кобальтомолибденовых
катализаторах.
Объектом исследования в данной работе является
катализатор (модифицированный ГО-70) процесса гидроочистки бензиновых,
керосиновых, дизельных и вакуумных газойлей от сероорганических примесей.
С
целью получения информации об объекте исследования в работе был проведен
дифференциально-термический, ИК-спектроскопический анализ зеленых и синих
гранул отработанного кобальтомолибденнового катализатора.
Дифференциально-термический
анализ был проведен в интервале температур 20 – 1000оС при скорости
нагрева 10 град/мин. Навеска образцов составила ~ 2г. Результаты анализа для
зеленых гранул приведены на рисунке 1, для синих гранул - на рисунке 2.
Из
рисунков 1 и 2 видно, что кривые DTA синих и зеленых гранул
различны. На кривой DTA зеленых гранул наблюдается два
эндотермических минимума различной величины при температурах 120оС и 420оС, тогда как, на
кривой DTA синих гранул – один эндотермический максимум при температуре 130оС.
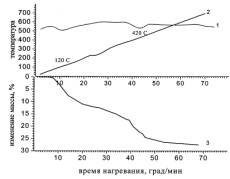
Рисунок 1. –
Дериватограмма зеленых гранул отработанного катализатора: 1- кривая DTA;
2- кривая T; 3- кривая TG.
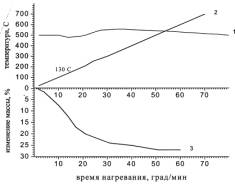
Рисунок 2. –
Дериватограмма синих гранул отработанного катализатора: 1- кривая DTA;
2- кривая T; 3- кривая TG.
По
полученным результатам дифференциально-термического анализа можно предположить
следующее, что зеленые гранулы представляют собой кристаллогидрат, при
нагревании которого происходит удаление кристаллизационной воды,
сопровождающееся перестройкой структуры вещества. Для подтверждения
предположения, что зеленые гранулы представляют собой кристаллогидрат, был
проведен спектральный анализ зеленых и синих гранул отработанного катализатора.
При анализе ИК-спектр синих гранул в области
3600-3200 см-1 наличие ряда полос (3095,3300,3500 см-1)
присущих валентным колебаниям О-Н группы и при 1630-1600 см полосы, характерной
для деформационного колебания Н-О-Н [3]. Тогда как ИК-спектр зеленых гранул в
области 3600-3200 см-1 имеет лишь одну широкую полосу, образование
которой можно объяснить адсорбцией воды. В спектре зеленых гранул в области
1200-1000 см-1 наблюдается полоса средней интенсивности, в ИК –
спектре синих гранул она отсутствует. На основании полученных результатов
дифференциально-термического и ИК-спектроскопического анализа было сделано
заключение, что зеленые гранулы представляют собой кристаллогидрат, который при
нагревании от 400оС до 600оС полностью теряет воду.
Потеря воды гранулами характеризуется изменением цвета с зеленого на синий.
Полученные данные соотносятся со свойствами соединений кобальта, согласно
которым в процессе нагревания на воздухе в интервале 400-600оС оксид
кобальта (II) переходит в оксид кобальта (II,III)
с изменением цвета оливково – зеленого на синий [2].
На
основании этого факта нами предлагается схема превращения соединений кобальта,
полученных осаждением из раствора, при заданном температурном интервале в оксиды кобальта.
Далее
отработанный катализатор сплавили с гидроксидом натрия в массовом соотношении
1:6 и температуре 330оС. По результатам сплавления отработанного
катализатора с гидроксидом натрия были получены следующие данные: при 120 мин.
масса плава уменьшилась на 6,35%, при 180 мин. на 6,92% и при 240 мин. – на
4,48% от первоначальной. Следовательно, наименьшие потери при сплавлении
отработанного катализатора с гидроксидом натрия будут наблюдаться при 330оС
в течение 240 мин. Полученные плавы растворили в воде, отфильтровали на вакуум
– насосе от осадка серо-белого цвета.
Также на основании экспериментальных
данных для смеси стандартных растворов кобальта и молибдена были определены
предельные концентрации, при которых совместное определение кобальта и
молибдена можно осуществлять по разработанной нами методике. Эти концентрации
составляют для кобальта - [0,1- 2,0] г/л; для молибдена - выше 0,1 г/л.
В результате анализа
экспериментальных данных был разработан способ разделения соединений кобальта и
молибдена, который состоит из следующих стадий:
·
Подготовка
сырья: отработанный кобальтомолибденовый катализатор, содержащий (%): MoO3
– 15-18; CoO – 4-5; Al2O3 - 72-86, размалывают в шаровых мельницах;
·
Приготовление
шихты: измельченный отработанный катализатор и гидроксид натрия дозируют
синхронно работающими дозаторами и смешивают в двухвальном лопастном смесителе;
·
Обжиг
шихты: шихту дозируют автоматами-дозаторами в прокалочные печи и проводят ее
сплавление при температуре 3300 С в течение 4 часов. Процесс
является сложным, гетерофазным. В нем при указанной температуре помимо
появления газовой и жидкой фазы имеется несколько твердых фаз, состав которых
зависит от режима термообработки. Условно сплавление шихты можно представить
следующими уравнениями реакций:
A12O3 + 2NaOH → 2NaA1O2 + H2O
MoO3 + 2NaOH
→ Na2MnO4 + H2O
·
Растворение
плава: выходящий из печи плав растворяют в воде в шаровой мельнице. При этом часть нерастворимого
остатка остается на сите с отверстиями 0,075 мкм. В процессе растворения
алюминаты натрия, молибдаты натрия переходят в раствор. При воздействии воды на
плав возможно протекание следующих реакций:
AL2O3 + 2NaOH + 3H2O → 3Na[A1(OH)4]
MoO3+2NaOH+3H2O → H2MoO4×H2O
+2NaOH
·
Экстрагирование:
выходящий из шаровой мельницы раствор поступает в экстрактор, где происходит
извлечение из водных слоя роданидных комплексов кобальта и молибдена
органическим растворителем. В качестве экстрагента используется ацетон, из
которого затем извлекается целевой компонент, и регенерированный экстрагент
возвращают в процесс. Оставшийся в растворе алюминий идет на переработку в
оксид алюминия (III);
·
Осаждение
соединений в виде геля: экстракт поступает в осадительные машины периодического
действия, которые представляют собой аппарат с коническим днищем и
перемешивающим устройством, куда также в качестве осадителя подается раствор 1М
NaOH. В зависимости от установления в смеси раствора,
определенного значения pH в интервале 11,20-12,60
выделяются соединения кобальта в виде мелкодисперсных гелей;
·
Промывка
осадков: полученные соединения кобальта и молибдена в виде мелкодисперсных
гелей, для их промывки от побочных продуктов хлоридных, роданидных, сульфатных
реакций, направляются в аппараты динамического действия, где разрушение
структуры достигается путем непрерывного смыва осадка скоростным напором
суспензии, вибрацией, пульсацией, центробежными силами;
·
Сушка:
отмытые от побочных продуктов осадки направляются на сушку в сушилки с кипящим
слоем tсушки=130ºС;
·
Обжиг:
высушенные осадки загружают в вращающиеся барабанные печи периодического
действия. Сначала загружают осажденные соединения кобальта и проводят процесс
при температуре процесса 420ºС в течение 4 часов, затем продукты обжига
выгружают и загружают осажденные соединения молибдена при температуре процесса
700 ºС, также в течение 4 часов. Полученные продукты обжига также
выгружают.
Литература
1.
Хацринова
Ю.А. Методика определения молибдена в продуктах реакции / Сборник материалов
Открытого конкурса научных работ студентов и аспирантов им. Н.И.Лобачевского. –
Казань, 2012: Издательство: Научный Издательский Дом. –С. 824с.
2.
Хацринова
Ю.А., Хацринов А.И. Способ разделения кобальта и молибдена в отработанных
катализаторах // Вестник Казанского технологического университета:Т.15.№8; М-во
образ. И науки России, Казан. нац.
исслед. технол. ун-т.- Казань: КНИТУ, 2012. С.46-50с.