Медицина/6. Экспериментальная и клиническая фармакология
Ладутько Ю.М., Смехова И.Е.
ГБОУ ВПО Санкт-Петербургская
государственная химико-фармацевтическая академия, Санкт-Петербург, Россия
ОЦЕНКА ФАРМАЦЕВТИЧЕСКОЙ ЭКВИВАЛЕНТНОСТИ ВОСПРОИЗВЕДЕННЫХ ПРЕПАРАТОВ ДЛЯ
ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
В настоящее время Россия занимает лидирующие позиции среди европейских
стран по количеству сердечно-сосудистых заболеваний (ССЗ). Самыми
распространенными из них являются артериальная гипертензия и ишемическая
болезнь сердца.
Многообразие лекарственных средств (ЛС) на
отечественном фармацевтическом рынке определяется не столько большим
количеством классов антигипертензивных средств и самих препаратов, но и
огромным количеством воспроизведенных препаратов (генериков). Их доля в России
по объему продаж составляет около 80% [1]. В стандартных схемах лечения ССЗ широко используются препараты
индапамида, атенолола, триметазидина, для которых в РФ зарегистрировано более
20 генериков для каждого. Генерическая замена – один из наиболее
очевидных способов снижения стоимости лечения и увеличения доступности терапии,
активно используемый во всем мире. Подавляющее большинство пациентов в России
по своим финансовым возможностям могут себе позволить только генерики [2]. До
32% взрослого населения принимает меньше ЛП, чем необходимо, из-за их высокой
стоимости [3]. Поэтому уменьшение стоимости ЛС, в т.ч. за счет применения менее
дорогого, но эффективного исследования качества лекарственных препаратов (ЛП), актуально.
В связи с расширением фармацевтического
рынка за счет генериков возникают вопросы оценки идентичности их действия по
сравнению с оригинальными препаратами, и необходимости проведения исследований
по определению их взаимозаменяемости, т.к. эффективность, безопасность, а также
выраженность побочных эффектов воспроизведенных ЛП могут существенно
различаться [4, 5].
К
генерикам и оригинальным ЛП должны быть применимы одинаковые требования:
высокое качество, необходимая эффективность и безопасность [6]. С целью обеспечения взаимозаменяемости при
фармакотерапии генерики должны быть фармацевтически, биологически и
терапевтически эквивалентны оригинальному препарату.
Фармацевтически эквивалентными считаются
лекарственные препараты, содержащие одно и то же количество одной и той же активной
фармацевтической субстанции (АФС) в одной и той же лекарственной форме, отвечающие
требованиям одних и тех же стандартов качества [7].
Целью исследования явилось изучение
кинетики растворения некоторых генериковых ЛС, применяемых для лечения заболеваний
сердечно-сосудистой системы, для оценки их фармацевтической эквивалентности в
соответствии с рекомендациями ВОЗ и ЕМА.
Для исследования были выбраны таблетки и капсулы
индапамида (10 производителей), атенолола (5 производителей) и триметазидина (9
производителей), представленные на российском фармацевтическом рынке.
В качестве препарата сравнения для
индапамида был выбран оригинальный препарат Арифон, производства «Лаборатории
Сервье Индастри». Для атенолола и триметазидина, в связи с отсутствием
оригинальных и в соответствии с рекомендациями ВОЗ, в качестве препаратов
сравнения были выбраны препараты Атенолол-Акри (ОАО «Химико-фармацевтический
комбинат “Акрихин”») и Медарум (ЗАО Фармацевтическое предприятие «Оболенское»).
Помимо активного ингредиента, фармацевтически
эквивалентные ЛП должны содержать одинаковые вспомогательные вещества (ВВ). В состав таблеток должны входить обычно
используемые, хорошо изученные ВВ, не влияющие на всасывание АФС и на моторику
ЖКТ. Чем ближе воспроизведенные препараты по составу к препаратам сравнения,
тем более вероятна их эквивалентность. Установлено, что, в отличие от
препаратов сравнения генерики таблеток индапамида, триметазидина, атенолола
некоторых производителей содержали супердезинтегранты: натрия
карбоксиметилкрахмал, натрия кроскармеллозу, крахмала натрия гликолят. Наличие
этих супердезинтегрантов, по-видимому, способствовало более быстрому
высвобождению АФС из таблеток этих производителей. В то же время все ВВ, входящие
в состав исследуемых генериков, типичны для таблеток и капсул, хорошо изучены и
широко используются.
Фармацевтическую эквивалентность исследуемых
генериков определяли по тесту «Растворение» в условиях, рекомендованных их
нормативной документацией (НД) или Фармакопеей США (USP). В настоящее
время оценка препаратов по этому тесту в
фаракопейном анализе проводится по одной временной точке. Для установления
фармацевтической эквивалентности мы строили кривые растворения и рассчитывали
коэффициент подобия (f2).
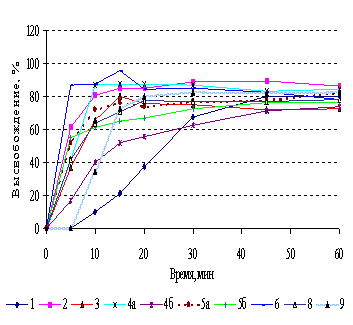
Установлено, что в среде кислоты
хлористоводородной (0,1М НС1) почти все таблетки индапамида соответствовали
требованиям НД: к 60 мин из них высвободилось более 75% АФС (рис. 1а). В
то же время в среде фосфатного буферного раствора с рН 6,8 (ФБ) требованиям
соответствовали лишь генерики двух производителей 3 и 6 (рис. 1б). Из таблеток Арифон® (1)
индапамид высвобождался с наименьшей скоростью как в ФБ, так и в 0,1М растворе
НС1. Различие в растворении наблюдалось не только между таблетками различных
производителей, но и между сериями одного и того же предприятия (например, серии
4а и 4б) (разница статистически достоверна). Независимо от применяемой
методики, лучшие результаты растворения получены для капсул, что закономерно
для данной ЛФ по сравнению с таблетками, а также для таблеток генериков производителей
3 и 6. Учитывая значение коэффициента
подобия (в среде ФБ f2 = 53,30) это позволило считать данные таблетки
фармацевтически эквивалентными между собой. На основании полученных результатов
в качестве дифференцирующей методики теста «Растворение» для таблеток
индапамида нами было предложено использование методики оригинального препарата.
|
|
|
|
1а. Методика НД: 0,1М НС1, ЛМ, 100об/мин |
1б. Методика USP: ФБ, ВК, 100об/мин |
|
Рисунок 1. Кривые растворения индапамида
из таблеток, п/о, различных производителей. |
|
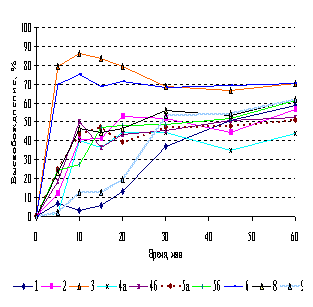
Испытание растворения таблеток атенолола
проводили в среде ацетатного буферного раствора с рН 4,5 (АБ) по методике Фармакопеи США, а также в растворе 0,1М
НС1 по методике НД. В среде АБ требованиям
соответствовали все исследуемые препараты: к 30 мин высвобождалось более 80% АФС.
Однако растворение проходило с разной скоростью (рис.2а). С наибольшей атенолол
высвобождался из таблеток производителя 1 (препарат сравнения), с наименьшей -
из таблеток производителя 4 (серия 4а). Высвобождение атенолола из генериков в
среде 0,1М НС1 также проходило с разной скоростью (рис 2б). Однако к 45 мин из
всех таблеток в среду растворения перешло требуемое количество вещества. Различие
в растворении наблюдалось также и между сериями таблеток одного и того же
предприятия. Так, из двух серий генериков атенолола производителя 4 (серии 4 и
4а) к 15 мин высвободилось соответственно 48,9 % и 94,1% (разница
статистически достоверна). Независимо от применяемой методики, лучшие
результаты растворения получены для таблеток производителя 1 (препарат
сравнения). Подобным препарату 1 в соответствии со значением f2
можно считать лишь генерик производителя 5 (серия 5а) в среде НС1 (f2=64,10).
Для остальных генериков коэффициент подобия относительно препарата сравнения 1
в обеих средах ниже 50.
Однако, некоторые из них фармацевтически эквивалентны между собой (в среде АБ -
генерики производителей 3 и 5 (f2=56,56); а также 2 и 5 (f2=55,18);
а в среде НС1 - производителей 2 и 3 (f2=64,87). Условия,
приведенные в USP для таблеток атенолола, позволяют
дифференцировать кривые растворения. Эти же условия рекомендованы USP для оценки биоэквивалентности таблеток атенолола.
|
|
|
|
2а. Методика USP: АБ, ЛМ, 50об/мин |
2б.
Методика ФСП: 0,1М НС1, ЛМ, 50 об/мин |
|
Рисунок
2. Кривые растворения атенолола из таблеток различных производителей |
|
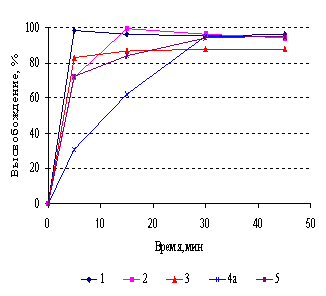
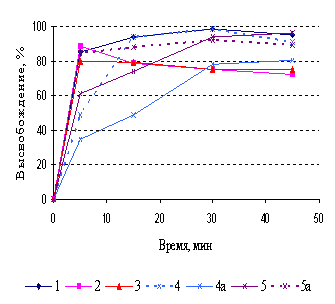
Методика теста «Растворение» для таблеток
триметазидина в нормативной документации различных производителей
унифицирована. Требованиям при
определении по одной точке соответствовали генерики триметазидина всех
производителей, однако, растворение проходило с различной скоростью (рис.3). Из
таблеток генериков 1-5 за 15 мин в
среду растворения перешло более 85% триметазидина, что позволило сделать вывод
об эквивалентности кинетики растворения этих препаратов без математической
оценки. Препараты производителей 6 и 8 достигали этого значения лишь к 30‑ой мин.
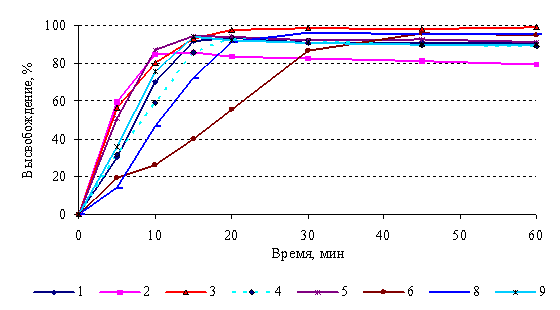
Рисунок 3. Кривые растворения
триметазидина из таблеток, п/о, различных производителей (условия растворения:
0,05М НС1, ЛМ, 50об/мин)
Таким образом, проведенное изучение
фармацевтической эквивалентности ЛП, выпускаемых разными отечественными и
зарубежными производителями, на примере таблеток атенолола, капсул и таблеток,
п/о, индапамида и триметазидина, показало, что, удовлетворяя требованиям теста
«Растворение» по норме высвобождения к заданному времени, ЛП во многих случаях различаются
профилями растворения. Тесты «Растворение», применяемые в настоящее время, не позволяют
получить адекватную информацию об эквивалентности генериков, что вызывает
необходимость использовать для этого построение кривых растворения. Условия
изучения высвобождения атенолола и индапамида из таблеток, позволяющие
дифференцировать профили растворения генериков, целесообразно использовать для
проверки постоянства межсерийного качества выпускаемой продукции.
Литература:
1.
Юргель, Н.В. Анализ
состояния фармацевтического рынка России / Н.В. Юргель // Ремедиум. – 2009. –
№2. – С.7.
2.
Белоусов, Ю.Б.
Результаты фармакоэпидемиологического исследования больных артериальной
гипертонией в России (ПИФАГОР II) / Ю.Б. Белоусов, М.В. Леонова, Д.Ю. Белоусов
и др. // Качественная клиническая практика. – 2004. – №1. – С. 17-27.
3.
Polli, J.E. In Vitro studies are sometimes better than conventional
human pharmacokinetic in vivo studies in assessing bioequivalence of
immediate-release solid oral dosage forms / J.E. Polli // The AAPS J. – 2008. – Vol.10, N2. – P. 289-299.
4.
Давыдова,
К.С. Оценка эквивалентности воспроизведенных лекарственных средств / К.С.
Давыдова // Фармация. – 2011. – №3. – С. 51-54.
5.
Марцевич, С.Ю.Выбор
лекарственного препарата в кардиологии: на что должен ориентироваться
практический врач? [Электронный ресурс] / С.Ю. Марцевич, // 2008. – Режим
доступа: http://www.kardioforum.ru/article.aspx?id=40&rid=18.
6.
Конюшкова, А.Н. Обзор требований
к исследованиям биоэквивалентности генерических лекарственных средств.
Требования FDA / А.Н. Конюшкова, А.Ю. Савченко, К.С. Давыдова и
др. // Ремедиум. – 2011. – №5. – С. 54–56.
7.
Смехова, И.Е. Тест «Растворение»
и современные подходы к оценке эквивалентности лекарственных препаратов (обзор)
/ И.Е. Смехова, Ю.М. Перова, И.А. Кондратьева
и др. // Разработка и регистрация лекарственных средств. – 2013. - № 2. – С.
50-61.