Д.м.н. Чистяков С.И., д.б.н. Балашов В.П.
НИ ФГБОУ ВПО «Мордовский государственный университет»,
Россия
ЭКСПЕРИМЕНТАЛЬНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ ПРОИЗВОДНЫХ ФОСФОРИЛУСКУСНОЙ
КИСЛОТЫ КАК ПОТЕНЦИАЛЬНЫХ СТРЕСС-ПРОТЕКТОРОВ
В АНЕСТЕЗИОЛОГИИ
Периоперационный
стресс в анестезиологии и реаниматологии на сегодняшний день остается
серьезнейшей проблемой из-за последствий, к которым приводят его различные
осложнения в до- и послеоперационном периоде[1].Учитывая, что существующие
современные препараты не всегда обеспечивают надежную профилактику
стресс-индуцированных состояний в анестезиологической практике, актуальность
поиска эффективных и безопасных средств для профилактики и лечения
периоперационного стресса очень высока.
Эксперименты проведены на 62 белых мышах. Стресс
воспроизводился иммобилизацией мышей по 3 часа в сутки в течение 3 суток [4].
Животных на 4 сутки забивали декапитацией под эфирным наркозом. Учитывая, что
одним из проявлений стресса является повреждение слизистой оболочки желудка (СОЖ), мы изучали
морфологические изменения в СОЖ как маркер стресса. Гистологические микропрепараты СОЖ окрашивали альциановым синим для
выявления кислыхмукополисахаридов, являющихся компонентом защитного
слизисто-бикарбонатного барьера[3]. Данный метод позволял оценить способность
секреторных клеток к слизеобразованию и определить степень сохранности
слизистого барьера желудка.
Микроскопию проводили при помощи светового
микроскопа Jenaval (Австрия) при малом (10х10х1,25) и большом
увеличении (10х40х1,25). Фотосъёмку
препаратов производили цифровой камерой САМ V 200 (Австрия) с обработкой
изображения в AdobePhotoshop
7.0 и морфометрическим исследованием в программе Видеотест – Мастер Морфология
(2005). Показатели “площадь защиты” рассчитывали в процентах от площади кадра препарата СОЖ. В качестве стресс-протекторного средства использовали
трифторуксуснокислую соль 4 – диметиламинофенил – 2 –
хлорэтокси-фосфорилацетилгидразида с лабораторным шифром (ХС 3635). Вещество
вводили в «профилактическом» (до воспроизведения стресса) и «лечебном» (после
воспроизведения стресса) режимах в дозе 4,3 мг/кг внутрибрюшинно. В качестве
препарата сравнения использовали Н2-блокатор фамотидин [2], вводился
также внутрибрюшинно в дозе 0,125 мг/кг до моделирования стресса, т.е. в
«профилактическом» режиме.
Микроскопия показала,
что в СОЖ интактного животного при окраске альциановым синим выявляются кислые
мукополисахариды, вырабатываемые слизеобразующими клетками и являющиеся
основным компонентом слизистого барьера желудка. В железах слизь выявляется в
основном в верхних и средних отделах. Количество секрета в слизистых клетках
различается в разных участках СОЖ. В некоторых участках отмечена интенсивная
реакция с красителем, а в некоторых лишь лёгкое прокрашивание апикальных
поверхностей клеток (рис. 1).
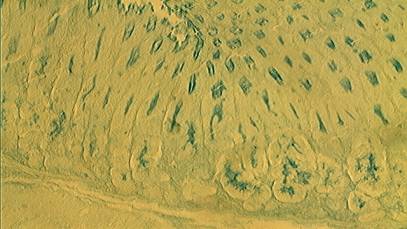
Рис.
1. Слизистая оболочка желудка интактного животного (х 180); окраска:
альциановый синий.
Стресс-индуцированная гастропатия характеризовалась
угнетением выработки слизи железами желудка (рис. 2; А, Б). Уменьшение
количества слизи отмечалось как на поверхности слизистой оболочки, и в её
базальной части.
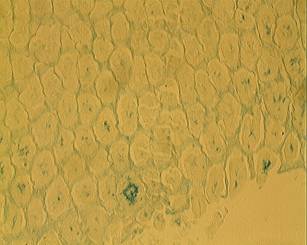
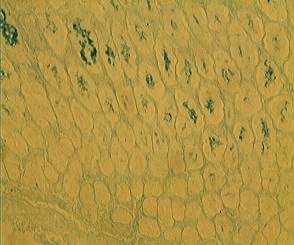
А Б
Рис.
2. Слизистая оболочка желудка мышей группы стресс-контроля (х 180); окраска:
альциановый синий. А и Б – различные участки СОЖ
Гастропротекторное действие
фамотидина, очевидно, не распространяется на активность слизеобразующих элементов
СОЖ. Количественное выражение этот факт нашел в показателе «площадь защиты»
(таблица 1), который составил 0,21%, что практически не отличается от уровня
стресс-контроля (0,23 %).
Таблица 1.
Степень сохранности слизистого барьера желудка при
воздействии фамотидином и ХС 3635
|
|
Интактные животные |
Стресс-контроль |
Стресс + Фамотидин |
Стресс + ХС3635проф. |
|
Площадь защиты, % |
0,81±0,023 |
0,23±0,051ª |
0,21±0,064 |
0,72±0,072* |
Примечание:
а – отличия от соответствующих показателей у интактных животных достоверны при
р<0,05; * – отличия от соответствующих показателей животных группы
стресс-контроля достоверны при р<0,05.
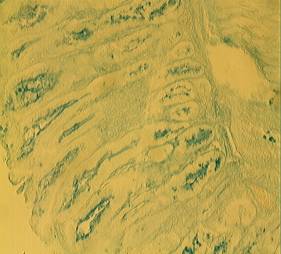
При хорошей сохранности
слизистой оболочки на её поверхности отмечались лишь единичные
"островки" слизи при практически полном отсутствии её резервов в
глубоких слоях (рис.3; А, Б).


А Б
Рис.3.
Слизистая оболочка желудка на фоне фамотидина при стресс-индуцированном
повреждении (А – х 180; Б – х 400); окраска: альциановыйсиний.

 «Профилактическое» введение ХС 3635 улучшало состояние
слизистого барьера в виде увеличения количества слизи в просвете желёз и на
поверхности СОЖ и на этом фоне – повышение сохранности клеток СОЖ (рис. 4; А,
Б).
«Профилактическое» введение ХС 3635 улучшало состояние
слизистого барьера в виде увеличения количества слизи в просвете желёз и на
поверхности СОЖ и на этом фоне – повышение сохранности клеток СОЖ (рис. 4; А,
Б).
А Б
Рис.4.
Участки слизистой оболочки желудка на фоне профилактического введения ХС 3635
при стресс-индуцированной гастропатии.
Окраска: альциановый синий: (А - х 180, Б - х 400).
Это подтверждается и
показателем «площадь защиты» (таблица 1), который увеличился втрое по сравнению
с уровнем стресс-контроля и достоверно не отличался от показателя интактных
животных.
При «лечебном» режиме введения
ХС 3635 (рис.5) показатель «площадь защиты» возрастал до 0,5% (р>0,05) (рис.
6), однако не достигал значений интактных животных, что свидетельствует лишь о
тенденции к улучшению состояния слизистого барьера.

Рис.5. Участок слизистой оболочки желудка на фоне
«лечебного» введения ХС 3635 при стресс-индуцированной гастропатии (х 180).
Окраска: альциановый синий.
Площадь защиты, * а
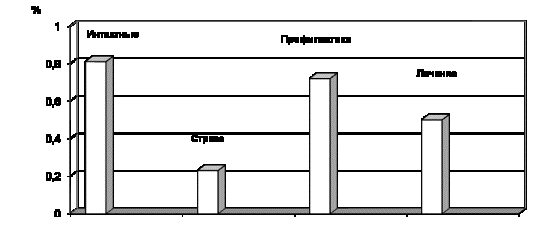
Рис.6.
Количественная характеристика состояния защитного слизистого барьера желудка
при стрессе и на фоне введения ХС 3635 в профилактическом и лечебном режимах
(4,3 мг/кг); а – отличия от значения “интактные” достоверны при p<0,05; * - отличия от значения “стресс” достоверны
при p<0,05.
Таким образом, изученные нами
протекторные свойства производного фенилфосфорилуксусной кислоты на примере
слизеобразования в эпителии желудка на фоне стресс-индуцированной гастропатии и
её коррекции подтверждает наличие у соединения 3635 стресс-протекторных
свойств, проявляющихся увеличением слизеобразующей активности эпителиоцитов и
степени сохранности слизистого барьера желудка.
Литература:
1.
Гвак
Г.В. Хирургический стресс. Клинико-лабораторные параллели в условиях активации естественных
стресс-лимитирующих систем/Г. В. Гвак, В.Г. Еременко, Е.А. Иванов, В.А. Сманцер
// Анестезиол. и реаниматол. – 2004. – № 4. – С. 33 – 35.
2.
Логинов
А.Ф. Возможности блокаторов Н2-гистаминовых
рецепторов в современной
гастроэнтерологии / А.Ф. Логинов, Е.А. Белоусова // Consiliummedicum. – 2003. –
Т.5. – №10. – С. 23-27.
3.
Семченко В.В. Гистологическая техника: учебное пособие. – 3-е
изд., доп. и перераб. / В.В. Сёмченко, С.А. Барашкова, В.Н. Ноздрин и соавт. //
Омск – Орел: Омская областная типография. – 2006. – 290 с.
4.
Desiderato O. Development of gastric
ulcers in rats following stress termination / O. Desiderato, J. MacKinnon, H.
Hissom // J. comp. physiol. Psychol. – 1974. – Vol. 87. – P. 208 – 214.