К.х.н.
Челядин В.Л.
Прикарпатський національний університет імені Василя Стефаника, Україна
Шляхи одержання розчинів
титановмісних аква- та гідроксо(аква)комплексів – прекурсорів синтезу ТіО2
кристалічної та рентгеноаморфної структури
На основі
сформованого огляду наукових публікацій щодо синтезу високодисперсного ТіО2
газофазним та рідкофазним методами можна стверджувати, що найбільш
перспективним прекурсором для одержання різних поліморфних модифікацій є TiCl4 [1]. Відомі сучасні знання
і уявлення про шляхи проходження хімічних процесів, які забезпечують утворення
оксидного матеріалу, не дозволяють стабільно отримувати продукт із наперед
заданими фізико-хімічними властивостями.
Результати наших досліджень показали,
що розчин титановмісного аквакомплексу [Ti(OH2)6]4+, отриманий у результаті взаємодії TiCl4
із HCl, є зручним прекурсором
для синтезу як кристалічних модифікацій TiO2 , так і рентгеноаморфних титанатних кислот [2]. При одержанні гідрокомплексного прекурсора хлоридну кислоту (34% водний розчин HCl) покраплинно вводили у TiCl4
(99,9 мас.% основної речовини). Масове співвідношення між реагентами
становило 1,4 : 1,0. Їх взаємодія супроводжується вилученням із
реакційного середовища молекул НCl та кисню, яке
можна подати рівнянням реакції:
TiCl4 + 8Н2О → [Ti(OH2)6]3+ + 4НCl + О2 . (1)
Відомо, що
ряд сполук, які містять в своєму складі атоми з проміжними ступінями окиснення,
здатні як підвищувати, так і понижувати їх і виконувати роль окисників або
відновників залежно від властивостей іншого учасника окисно-відновної реакції [3–5]. Самоокиснення-самовідновлення
(дисмутації) – це реакції, під час яких перехід електронів відбувається між
однаковими атомами однієї і тої ж молекули.
Відновлення чотирьохвалентних атомів титану в прекурсорі до трьохвалентного
стану Ті3+ у аквакомплексах [Ti(OH2)6]3+ є проявом каталітичної дії
атомів титану суперкислоти (TiCl4) на процес дисоціації
молекул води та утворення радикальних групувань ![]() :
:
![]() (2)
(2)
![]() (3)
(3)
Як
підтвердження проходження саме окисно-відновної реакції можна зазначити, що в
якості відновника виступає тетрахлорид титану, а окисника – пероксид водню,
який генерується з води під дією хлоридної кислоти. У результаті здійснення
окисно-відновної реакції молекули Н2О2 деградують з
утворенням молекул ![]() та
та ![]() :
:
![]() (4)
(4)
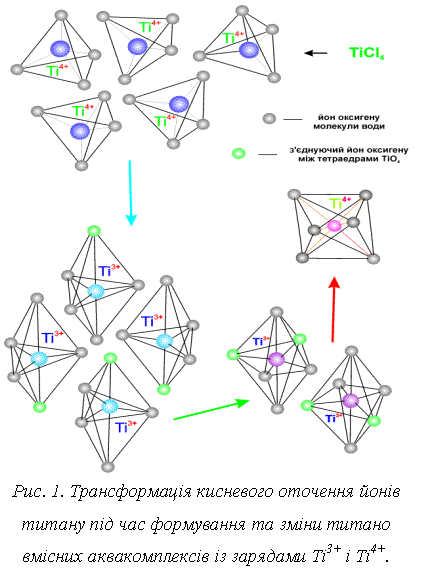 Підчас
окиснення молекулами кисню катіонів Ti3+ у Ti4+ відбувається зміна координаційного оточення щодо оксигену – з
тетраедричного в октаедричне, яке схематично зображено на рис. 1.
Підчас
окиснення молекулами кисню катіонів Ti3+ у Ti4+ відбувається зміна координаційного оточення щодо оксигену – з
тетраедричного в октаедричне, яке схематично зображено на рис. 1.
Аквакомплекси
тетракоординованих йонів Ti3+ в умовах температури реакційного
середовища вище 80°С самоорганізовуються у метитанову кислоту ТіО(ОН)2 .
Два аніони оксигену в оточенні
катіонів титану задіяна на утворення містків > Тi – O – Тi < , а інші два – аніонів О2-, які входять у склад ОН груп та молекул
води
(рис. 2).
Для збереження валентного балансу аніонів О2- в октаедрах ТіО4 гідрокси-
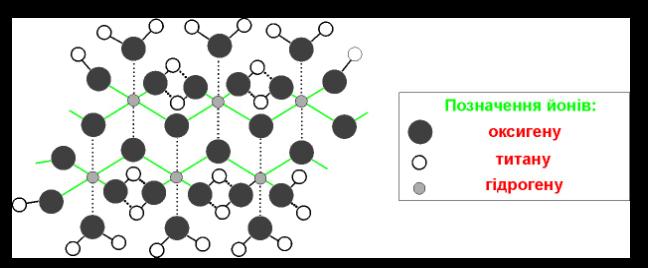
Рис. 2. Модель будови метатитанової кислоти ТіО(ОН)2 ∙ Н2О.
льні групи сусідніх атомів титану
вимушені утворювати між собою водневі зв’язки.
У сформованих
аквакомплексах [Ti(OH2)6]3+
при зростанні рН реакційного середовища до 0 ÷ 0,5 атоми Ті3+ самочинно окислюються – віддають електрон одній з
оточуючих молекул води. Це також приводить до їх дисоціації, однак у даному
випадку процес супроводжується утворенням молекулярного водню та аніонів ![]() :
:
![]() (5)
(5)
Атоми Ті4+
в аквакомплексах приєднують аніони ![]() , утворюючи ковалентний зв’язок ≡ Ті –ОН. У міру зростання
рН середовища ступінь гідроксильованості атомів титану в аквакомплексах
збільшується і вони трансформуються у гідроксо(аква)комплекси [Ti(OH)m(OH2)6-m](4-m)+,
, утворюючи ковалентний зв’язок ≡ Ті –ОН. У міру зростання
рН середовища ступінь гідроксильованості атомів титану в аквакомплексах
збільшується і вони трансформуються у гідроксо(аква)комплекси [Ti(OH)m(OH2)6-m](4-m)+,
в яких 1 ≤ m ≤ 6.
Хімічний стан
прекурсора за різних значень рН реакційного середовища показаний в таблиці 1.
Додавання в
розчин титановмісного гідроксо(аква)комплексу за температури реакційного
середовища 40–60°С розкислювача (NaHCO3 ,
розчинів Н2О2 або NaOH) активує конденсаційний
процес і приводить до утворення частинок діоксиду титану. У таблиці 2 приведені
умови одержання дослідних зразків ТіО2 та їх фізико-хімічні
характеристики.
![Подпись: Таблиця 1.
Залежність хімічного складу розчинів титановмісних гідроксо(аква)комплексів від рН реакційного середовища [6]
рН Хімічна формула
-1,3 [Ti(OH)(OH2)5]3+
1,0 [Ti(OH)2(OH2)4]2+
3,7 [Ti(OH)3(OH2)3]+
6,7 [Ti(OH)4(OH2)2]0
10,2 [Ti(OH)5(OH2)]–
14,3 [Ti(OН)6]2–](./2_121793.doc.files/image022.gif) Для кислого реакційного середовища (рН= 1,0 ÷ 2,5) у розчині домінують гідроксо(аква)комплекси
[Ti(OH)2(OH2)4]2+, які забезпечують утворення частинок рутилу
у вигляді стрижнів діаметром 3 ÷ 6 нм
та довжиною 6 ÷ 13 нм. На стадії висушування гідрогелю вони об’єднуються в асоціати
розмірами 100–500 нм (рис. 3, а, б). У середовищі з рН ~ 3,0 ÷ 4,8
конденсація прекурсора [Ti(OH)3(OH2)3]+
приводить до утворення продукту, що містить фази анатазу і брукіту з сферичними
або еліпсоїдними нанокристалітами діаметром 3 ÷ 7 нм (рис. 3, в, г).
Для кислого реакційного середовища (рН= 1,0 ÷ 2,5) у розчині домінують гідроксо(аква)комплекси
[Ti(OH)2(OH2)4]2+, які забезпечують утворення частинок рутилу
у вигляді стрижнів діаметром 3 ÷ 6 нм
та довжиною 6 ÷ 13 нм. На стадії висушування гідрогелю вони об’єднуються в асоціати
розмірами 100–500 нм (рис. 3, а, б). У середовищі з рН ~ 3,0 ÷ 4,8
конденсація прекурсора [Ti(OH)3(OH2)3]+
приводить до утворення продукту, що містить фази анатазу і брукіту з сферичними
або еліпсоїдними нанокристалітами діаметром 3 ÷ 7 нм (рис. 3, в, г).
Таблиця 2.
Умови одержання дослідних зразків ТіО2 та їх
фізико-хімічні властивості [7]
|
№ зразка |
Розкислювач |
рН реакційного середовища |
Хімічний стан прекурсора |
Фазовий склад, % |
Форма та нм |
Узагальнена формула матеріалу |
|
1 |
Н2О |
1,0 |
[Ti(OH)2(OH2)4]2+ |
рутил – 100 |
стрижень; 12×6 |
TiO2 ∙ 0,46Н2О |
|
2 |
Н2О2 |
1,5 |
рутил – 100 |
стрижень; 13×4 |
TiO2 ∙ 0,24Н2О |
|
|
3 |
Н2О |
2,0 |
рутил – 100 |
голка; 8×3 |
TiO2 ∙ 0,13Н2О |
|
|
4 |
NaОH |
3,7 |
[Ti(OH)3(OH2)3]+ |
анатаз – 97 брукіт – 3 |
еліпсоїд; 5×3 еліпсоїд; 7×4 |
TiO2 ∙ 0,15Н2О |
|
5 |
NaHCO3 |
4,4 |
анатаз – 43 брукіт – 57 |
еліпсоїд; 6×3 еліпсоїд; 4×3 |
TiO2 ∙ 0,21Н2О |
|
|
6* |
NaHCO3 |
11,0 / 5,0 |
[Ti(OH)5(OH2)]– |
анатаз – 100 |
еліпсоїд; 20×15 |
TiO2 ∙ 0,32Н2О |
|
7** |
- |
- |
анатаз – 100 |
призма; 130 |
TiO2 ∙ 0,02Н2О |
* – на початковому етапі синтезу проточастинки ТіО2 відділяли від реакційного середовища з рН ~ 11,0 ÷ 11,5 і подальшу їх кристалізацію вели у середовищі при рН ~ 5,0.
** – дослідний зразок 6 прожарювали впродовж 3
годин при температурі 400°С.
 Слабокисле та слаболужне середовище (5,5 ÷ 8,5) є сприятливим для
формування еліпсоїдних нанокристалітів анатазу. Їх розмір становить
10×30 нм.
Слабокисле та слаболужне середовище (5,5 ÷ 8,5) є сприятливим для
формування еліпсоїдних нанокристалітів анатазу. Їх розмір становить
10×30 нм.
Для
запобігання кристалізації брукіту в дослідному зразку 6 формування
зародків анатазу здійснювали у реакційному середовищі з рН=11,0–11,5
впродовж 15 хвилин при температурі 60°С. Одержаний рентгеноаморфний продукт
ТіО2 відділяли від дисперсійного середовища з допомогою
вакуум-фільтра та промивали його дистильованою водою для вилучення розчину NaCl. Подальшу кристалізацію частинок здійснювали у
підкисленому до рН=5,0 водному середовищі також при температурі 60°С.
![Подпись:
Рис. 4. ІЧ-спектри TiCl4 (1), хлористоводневої кислоти (2), розчинів титановмісних гідрокомплексів [Ti(OH2)6]4+ (3), [Ti(OH)2(OH2)4]2+ (4) та діоксиду титану: зразок 1 (5), зразок 6 (6).](./2_121793.doc.files/image026.gif) Ми виявили, що вплив умов синтезу на кристалічну будову
частинок ТіО2 обумовлений залежністю середньої довжини зв’язку
Ті–О в октаедрах прекурсора від ступеня гідроксильованості його атомів титану [8].
Ми виявили, що вплив умов синтезу на кристалічну будову
частинок ТіО2 обумовлений залежністю середньої довжини зв’язку
Ті–О в октаедрах прекурсора від ступеня гідроксильованості його атомів титану [8].
Зазначений взаємозв’язок чітко простежується при порівнянні частотних
характеристик смуг валентних коливань зв’язку Ті–О в ІЧ-спектрах прекурсорів
та кристалічних фаз синтезованих зразків ТіО2 (рис. 4).
У процесі синтезу
кристалізація необхідної фази забезпечується тільки у випадку рівності або
близькості середніх значень відстаней Ті–О для молекул
прекурсора та в октаедрах TiO6 поліморфної модифікації TiO2 . Оскільки ступінь
гідроксильованості атомів титану комплексного титановмісного прекурсора залежить від рН реакційного середовища й даний показник, в основному, визначає довжину
титанокисневих зв’язків, тому змінюючи рН можна корегувати просторову будову
молекул прекурсора і у такий спосіб забезпечувати одержання оксидного матеріалу
із наперед заданою структурою.
Литература:
1. І.Ф. Миронюк,
В.Л. Челядин. Методи одержання діоксиду титану (огляд) // ФХТТ. – 2010. –
Т.11. – №4. – С. 815–831.
2. Л.І. Миронюк, В.Л. Челядин, І.Ф. Миронюк. Атомна будова та морфологія частинок політитанатних кислот, одержаних за
різних умов рідкофазного синтезу // ФХТТ. – 2012. – Т. 13, № 1. – С. 156–165.
3. В.І. Кабачний, Л.К.
Осіпенко, Л.Д. Грицан та ін. Фізична і колоїдна хімія. Прапор, Видавництво
УкрФА, Х., 368 с. (1999).
4. И.А. Пресс. Химия. Превращение вещества:
Учеб. пособие. – СПб.: СЗТУ, 2004. – 219 с.
5. К.С. Краснов, Н.В. Филиппенко, В.А.
Бобкова и др. Молекулярные постоянные неорганических соединений: Справочник.
Под. ред. д.х.н. Краснова К.С., Химия, Л., 448 с. (1979).
6. M. Henry, J.P. Jolivert, J. Livage.
Aqueous chemistry of metal cations: hydrolysis, condensation, and complextion,
in structure and bonding. Ed. R. Reisfeld, C.K. Jorgensen, Berlin:
Springer-Verlag. – P. 180–181 (1992).
7. І.Ф. Миронюк, В.Л. Челядин, В.О.
Коцюбинський та ін. Будова та морфологія частинок ТіО2 , одержаних
рідкофазним гідролізом ТіCl4 // ФХТТ.
– 2011. – Т. 12, № 2.
– С. 416–427.
8. Obtaining of titanium dioxide by TiCl4 hydrochlorid-acid
hydrolysis / [V.L. Chelyadyn, I.F. Myronyuk, V.O. Kotsyubynsky, V.V.
Dmytruk] // Materials of the Mediterranean-East-Europe Meeting “Multifunctional
Nanomaterials (NanoEuroMed 2011)”, 12–14 May 2011 y., Uzhgorod : meeting
reports.
– Uzhgorod, 2011. – P. 180–181.
ХИМИЯ И ХИМИЧЕСКИЕ ТЕХНОЛОГИИ
7. Неорганическая химия.