Химия и химические технологии / 5. Фундаментальные проблемы
создания новых материалов и технологий
Цесарчук Н. С., Зайцева І. С.
Харківська
національна академія міського господарства, Україна
Теоретичне
вивчення циклічних водних кластерів (H2O)n (n = 1‑6), а також
кластерів каркасної будови
Важливість хімії води при вивченні
багатьох хімічних і біологічних процесів викликало безліч
експериментальних, а також
розрахункових досліджень, спрямованих
на з'ясування структури і властивостей води [1]. Детальне дослідження малих кластерів води є одним із засобів,
що дозволяють отримати уяву про надмолекулярну структуру цієї важливої речовини
і пояснити її специфічні, досить суперечливі властивості.
Квантовохімічним
розрахункам кластерів води присвячено ряд публікацій. В роботі [2] наведено
дані розрахунку димера і тримера води методом RHF. Показано, що використання
MP2-кореляції позначається на молекулярних параметрах. Авторами виконано
порівняння розрахункових молекулярних параметрів із даними, які були одержані з
коливального спектру.
В роботі [3] проаналізовано вплив метода розрахунку поправки теорії
збурень (MP2, MP4) базису на молекулярні параметри на прикладі кластерів (H2O)n, n = 1...6. Показано,
що оптимальним є використання RHF в базисі aug-сс-pvdz із використанням MP2
кореляції; використання збурення 4 порядку не приводить до суттєвих змін
молекулярних параметрів.
Авторами в роботі [4] напівемпіричним методом розраховано каркасні
кластери типу (H2O)n, n = 8...20 кубічної й пентагондодекаедральної
структури. Автори дійшли думки, що дані структури не реалізуються, тобто
дослідження мають інтерес з теоретичної точки зору.
Роботу [5]
присвячено розрахункам лінійних кластерів (H2O)n з різною геометрією
методом DFT, а також їх іонізованим копіям.
Існує величезна кількість розрахункових даних, в тому числі отриманих напів-емпіричними, ab initio та
кореляційними методами.
Метою
даного дослідження був розрахунок молекулярних кластерів складу (H2O)n (n = 1‑6) неемпіричним
методом, аналіз впливу кластероутворення на середню енергію молекули, міцність
водневого зв'язку, на молекулярні параметри.
Для вирішення завдань даної роботи зроблено розрахунок
структури молекулярних кластерів (H2O)n, де n = 2, 3, 4, 6, та
здійснено порівняння їх молекулярних параметрів між собою та з відповідними
параметрами для неассоційованої молекули H2O. Для структур (H2O)n з n = 3 – 6 розглянуто лише циклічні кластери.
Оптимізацію
геометрії всіх структур здійснено методом RHF у базисі aug-cc-pvdz з урахуванням MP2-кореляції [6].
Молекула води. За
даними розрахунків, довжина зв'язків О‑Н складає 0,966 Å, валентний
кут НОН – 103,7º.
Димер води. З отриманих даних
видно, що утворення водневого зв'язку найбільшою мірою позначається на зміні
довжини зв'язку О-Н молекули-донора протону (зміна становить 0,007 Å).
В молекулі-акцепторі протону також спостерігається незначне збільшення довжини зв'язку
(0,001Å). Ці зміни пояснюються перерозподілом електронної густини за
рахунок утворення водневого зв'язку. Слід звернути увагу також на незначне
збільшення валентних кутів (0,3-0,4º), що свідчить про збільшення
s-характеру відповідних гібридних орбіталей (sp3→sp2) в обох молекулах. Довжина
водневого зв'язку в кластері дорівнює 1,959Å. Виграш в енергії при
утворенні кластеру 2 H2O ![]() (H2O)2 становить
21,74 кДж/моль. Кут фрагменту Н···О-Н дорівнює 170,20, тобто не
відповідає строго ідеальному для міжмолекулярного водневого зв'язку значенню
1800.
(H2O)2 становить
21,74 кДж/моль. Кут фрагменту Н···О-Н дорівнює 170,20, тобто не
відповідає строго ідеальному для міжмолекулярного водневого зв'язку значенню
1800.
Тримери води. Для циклічного тримеру
(H2O)3 виявлено два потенціальних мінімуми, які відрізняються
відносною орієнтацією зв'язків О‑Н: в одному з них (А) два зв'язки
орієнтовано з одного боку від площини атомів Оксигену, а третій – з іншого
боку; в другому (В) – усі три зв'язки знаходяться з одного боку (рис.2). Найбільш
низьку енергію має кластер А; різниця в енергіях форм А і В дорівнює 3,34
кДж/моль. Необхідно зазначити, що обидва кластери мають практично трикутну
форму з вершинами в точках, що відповідають ядрам атомів кластеру. Атоми
Гідрогену, які приймають участь в утворенні водневого зв'язку мало відхиляються
від лінії О-О. Валентні кути О-Н···О становлять 149,10 ‑151,50, валентні кути Н-О···О –
89,60 – 88,80. Довжини водневих зв'язків в кластері А
становлять 1,928Å, що на 0,03Å коротше, ніж у кластері (H2O)2.
Такий ефект, а також дещо більший виграш в енергії в перерахунку на один
водневий зв'язок (22,6 кДж/моль) в порівнянні з (H2O)2,
може бути пов'язаний частково з реалізацією 6p‑електронної квазіароматичної системи.
Тетрамер і гексамер. Нами розглянуто по
одному циклічному кластеру складу (H2O)4 і (H2O)6,
в яких орієнтація О-Н зв'язків чергується відносно площини, яку утворюють атоми
Оксигену (рис. 3). Розрахунки показали, що обидва кластера містять міцні
водневі зв'язки довжиною відповідно 1,780 Å і 1,739 Å (що
в середньому на 0,20 Å менше, ніж в (H2O)2) з
енергіями 29,8 і 32,1 кДж/моль відповідно.

Рис. 1. Димер води

А В
Рис. 2. Тример води

Рис. 3. Тетрамер і
гексамер води

Рис. 4. Кластер води
структури (H2O)5


Рис. 5. Кластери
каркасної будови ((H2O)3)2 (зліва) і ((H2O)4)2
(справа)

Рис. 6. Кластери
каркасної будови ((H2O)6)2
З метою
вивчення впливу кластероутворення на енергію окремої молекули води і окремий водневий
зв'язок, окрім кластерів складу (H2O)n, n = 2, 3, 4, 6 розрахували також кластери (H2O)5 (рис. 4)
та кластери каркасної будови: ((H2O)3)2, ((H2O)4)2,
(рис. 5) ((H2O)6)2 (рис. 6). Енергія всього
кластера практично лінійно залежить від числа молекул води в кластері (рис. 7).
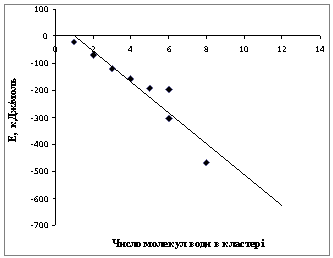
Рис. 7. Залежність
енергії кластера від числа молекул води в кластері
Вплив
кластероутворення на енергію окремої молекули води і водневий зв'язок наведено на рис. 8, 9. Енергія окремої молекули води
знижується зі збільшенням числа молекул води в кластері до n » 10, при подальшому
збільшенні числа молекул води енергія практично не змінюється і дорівнює
приблизно 40 кДж/моль (рис. 8). Енергія водневого зв'язку в середньому мало
залежить від кількості молекул води в кластері й має величину, яка приблизно
дорівнює 20‑35 кДж/моль (рис. 9).
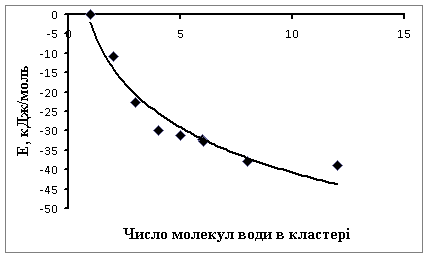
Рис. 8. Залежність
енергії молекули води від числа молекул води в кластері

Рис. 9. Залежність
енергії водневого зв'язку від числа молекул
в кластері води
Література
[1] Stumm Werner Aquatic
chemistry: chemical equilibria and rates in natural waters / Werner Stumm,
James J. Morgan.—3rd ed. p. cm.—(Environmental science and technology) "A
Wiley-Interscience publication." 1996. 1005 p.
[2] Sotiris S. Xantheas, Thom H.
Dunning, Jr. The structure of the water trimer from ab initio calculations. J. Chem. Phys. 1993. Vol. 98. No. 10, 15
May. P. 8037 – 8040.
[3] Sotiris S. Xantheas Ab initio studies of cyclic water
clusters (H2O)n, n = 1-6. II. Analysis of many-body
interactions. J. Chem. Phys. 1994. Vol. 100. No. 10, 15 May. P. 7523 – 7534.
[4] Arshad Khan Examining the
Cubic, Fused Cubic, and Cage Structures of (H2O)n for n =
8, 9, 12, 16, 20 and 21: Do Fused Cubic Structures Form? J. Chem. Phys. 1995.
Vol. 99. No. 33. P. 12450 – 12455.
[5] Y. Indra Neela, A. Subha
Mahadevi, and G. Narahari Sastry Hydrogen Bonding in Water Clusters and Their
Ionized Counterparts. J. Chem. Phys. B. 2010. Vol. 114. No. 51. P. 17162 –
17171.
[6] Alex A. Granovsky, Firefly
version 7.1.G, http://classic.chem.msu.su/gran/firefly/index.html.