Семакин С.В.,
Киселев С.А., Аширов Р.В.
Национальный исследовательский Томский
политехнический университет
Синтез диэфиров
экзо,экзо-норборнен-2,3-дикарбоновой кислоты
В
последние три десятилетия метатезисная полимеризация с раскрытием цикла (Ring Opening Metathesis Polymerisation) стала широко
применяемым способом получения функционализированных полимеров. Катализаторы
метатезиса на основе рутения обладают высокой толерантностью к большинству полярных
функциональных групп, а разнообразие вовлекающихся в процесс соединений и
возможность контролировать архитектуру получаемых полимеров делает актуальным
разработку способов синтеза доступных мономеров с целью их применения в синтезе
высокомолекулярных соединений [1, 2]. Одними из самых доступных веществ, способных
на превращения в процессе метатезисной полимеризации с раскрытием цикла
являются производные норборнен-2,3-дикарбоновой кислоты, которые можно
синтезировать в реакции Дильса-Альдера производных малеиновой кислоты и
циклопентадиена.
Метатезисная
полимеризация с раскрытием цикла диэфиров норборнен-2,3-дикарбоновых кислот в
присутствии молибден- или рутений содержащих катализаторов может привести к
образованию полимеров, имеющих высокую регулярность микроструктуры [3,4]. Формирование
той или иной микроструктуры полимера на основе диэфиров
норборнен-2,3-дикарбоновой кислоты предопределяет физико-механические свойства
полимера.
В данной
работе описан синтез нескольких новых диэфиров
экзо,экзо-норборнен-2,3-дикарбоновой кислоты, которые могут быть использованы в
качестве мономеров в ROMP. Были разработаны
методики синтеза и выделения следующих диэфиров из реакционных смесей: ди-н-пропилового,
ди-н-бутилового, ди-изо-бутилового, ди-н-пентилового. Ранее были известны
лишь диметиловый и диэтиловый эфиры
данной кислоты [5], вновь полученные эфиры ранее в литературе описаны не были.
Синтез
диэфиров осуществлялся по реакции этерификации (рисунок 1) в присутствии
небольшого количества пара-толуолсульфокислоты,
используемой в качестве катализатора. Исходными реагентами служили ангидрид экзо,экзо-норборнен-2,3-дикарбоновой
кислоты и соответствующие спирты.
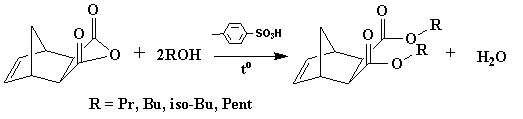
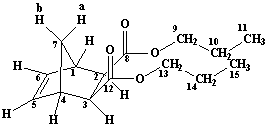
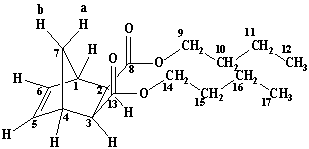
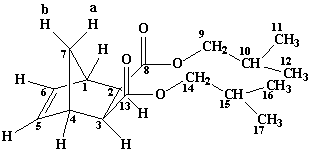
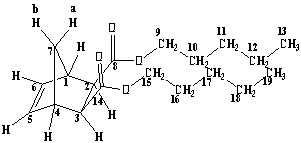
Рисунок
1. Синтез диэфиров экзо,экзо-норборнен-2,3-дикарбоновой кислоты.
Процесс
проводился при кипячении реакционных смесей на масляной бане (температуры
синтезов приведены в таблице 2). Для достижения наибольшего выхода продукта использовался
избыток спирта, с периодическим выведением из реакции водно-спиртового
азеотропа посредством насадки Дина-Старка. Реагенты загружались в круглодонную
колбу на 250 мл в следующих количествах: ангидрид
– 10 г, спирты – по 90 мл, пара-толуолсульфокислота
– 35 мг. Время проведения синтезов указано в таблице 2. За конверсией исходного
ангидрида в течение синтеза следили при помощи хроматографического анализа проб
реакционной смеси, используя газовый хроматограф с масс-селективным детектором Agilent
7890A/MSD5975C. Итоговые результаты анализов ГХМС для четырех синтезов
приведены в таблице 1.
Таблица 1. Результаты анализов ГХМС проб
реакционных смесей по окончании синтезов.
|
Состав
смеси |
Ди-н-Pr |
Ди-н-Bu |
Ди-изо-Bu |
Ди-н-Pent |
|
Ангидрид,
% |
5,40 |
2,14 |
6,75 |
2,43 |
|
Моноэфир,
% |
2,50 |
0,36 |
1,46 |
1,34 |
|
Диэфир,
% |
92,10 |
97,50 |
91,80 |
96,22 |
Для нейтрализации пара-толуолсульфокислоты к полученным
реакционным смесям добавлялось по 0,8 г K2CO3, содержимое тщательно перемешивалось, затем смесь
фильтровалась от твердого K2CO3. Избыток спирта отгонялся на роторном испарителе при
разряжении. Для связывания моноэфира (рисунок 2) к продуктам прибавлялись по 50
мл CH2Cl2 и 20 мл 5 %-го раствора NaOH, далее содержимое колб интенсивно перемешивалось.
Смеси промывались дистиллированной водой, водный слой сливался, а органическая
фаза упаривалась на роторном испарителе от CH2Cl2. Для отделения ангидрида от целевого продукта к полученным
сиропообразным жидкостям приливалось по 80 мл н-гептана, колбы помещались в
морозильник при температуре -14 °C на 10 часов. Выпавший
осадок ангидрида фильтровался, а н-гептан отгонялся на роторном испарителе.
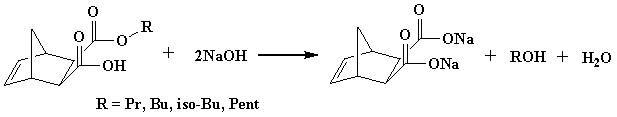
Рисунок 2. Реакция нейтрализации
моноэфиров водным раствором NaOH.
С целью определения чистоты полученных
диэфиров их пробы были проанализированы с помощью 1H ЯМР-спектрометрии.
Выход и чистота по ЯМР полученных диэфиров указаны в таблице 2.
Таблица 2. Характеристика проведения
синтезов диэфиров экзо,экзо-норборнен-2,3-дикарбоновой кислоты.
|
Синтез диэфира |
Тсинтеза, ºС |
Время, ч |
Выход, % |
Чистота по ЯМР, % |
|
Ди-н-пропиловый |
118 |
12 |
71,2 |
98,6 |
|
Ди-н-бутиловый |
140 |
12 |
82,9 |
99,0 |
|
Диизобутиловый |
136 |
10 |
84,6 |
98,1 |
|
Ди-н-пентиловый |
148 |
10 |
88,7 |
98,5 |
Описание 1H ЯМР-спектров четырех диэфиров приводится в таблице 3.
Таблица 3. Описание 1H ЯМР-спектров диэфиров
экзо,экзо-норборнен-2,3-дикарбоновой кислоты.
|
Ди-н-пропил-экзо,экзо-норборнен-2,3-дикарбоксилат ЯМР Н1 СDCl3: 0.92 т. (6H C11, C15 3J 7.4); 1.49 д.т. (1H bC7, 2J 8.8); 1.55-1.68 м. (4H C10, C14); 2.13 д. (1H aC7, 2J 8.8); 2.60 д. (2H C2, C3, 3J 2.0); 3.07 ш.с. (2H C1, C4); 3.9-4.08 м. (4H C9, C13); 6.20 с. (2H C5, C6) |
|
|
Ди-н-бутил-экзо,экзо-норборнен-2,3-дикарбоксилат ЯМР Н1 СDCl3: 0.92 т. (6H C12, C17, 3J 7.2); 1.3-1.4 м. (4H C11,C16); 1.46 д.т. (1H bC7, 2J 9.2 ); 1.52-1.60 м. (4H C10, C15); 2.12 д. (1H aC7, 2J 9.2); 2.59 д. (2H C2, C3, 2J 2.0); 3.07 ш.с. (2H C1, C4); 3.92-4.12 м. (4H C9, C14); 6.20 с. (2H C5, C6) |
|
|
Диизобутил-экзо,экзо-норборнен-2,3-дикарбоксилат ЯМР Н1 СDCl3: 0.91 д. (12H С11, С12, С16, С17, 3J 6.8); 1.48 д.т. (1H bС7, 2J 9.2, 3J 1.6); 1.84-1.95 м. (2H C10, С15); 2.13 д. (1H aС7, 2J 9.2); 2.62 д. (2H С2, С3, 3J 2.0); 3.08 ш.с. (2H С1, С4); 3.71-3.89 м. (4H C9 , С14); 6.20 с. (2H C5, С6) |
|
|
Ди-н-пентил-экзо,экзо-норборнен-2,3-дикарбоксилат ЯМР Н1 СDCl3: 0.86 т. (6H C13, С19, 3J 6.8); 1.2-1,35 м. (8H C11, С12, С17, С18); 1.44 д.т. (1H bC7, 2J 9.2); 1.50-1.63 м. (4H С10, С16); 2.09 д. (1H aC7, 2J 9.2); 2.56 д. (2H С2, С3, 3J 1.6); 3.03 ш.с. (2H С1, С4); 3.88-4.08 м. (4H С9, С15); 6.16 с. (2H С5, С6) |
|
Таким образом, был разработан удобный и эффективный
метод получения четырех диэфиров
экзо,экзо-норборнен-2,3-дикарбоновой кислоты, позволяющий избежать изомеризации
ангидрида и эфиров экзо,экзо-норборнен-2,3-дикарбоновой кислоты в процессе синтеза. Диэфиры
представляют собой маслянистые жидкости, вязкость их уменьшается в ряду ди-н-Pr –
ди-н-Pent.
Литература:
1.
Fuerstner, A. Angew. Chem., Int. Ed. 2000, 39, 3012-3043.
2.
Trnka, T. M.; Grubbs, R. H. Acc. Chem. Res. 2001, 34, 18-29.
3. Margaret M. Flook,
Victor W. L. Ng, and Richard R. Schrock. J. Am. Chem. Soc. 2011, 133, 1784–1786.
4. Benjamin K. Keitz,
Alexey Fedorov, and Robert H. Grubbs. J. Am. Chem. Soc. 2012, 134, 2040-2043.
5. Bloch, R.;
Guibe-Jampel, E.; Girard, C.; Tetrahedron Letters; vol. 26; nb. 34; (1985); p.
4087-4090.