Химия и химические технологии / 2. Теоретическая химия.
Цесарчук Н. С., к.х.н. Зайцева І. С.
Харківський
національний університет
міського
господарства імені О. М. Бекетова, Україна
Порівняльне
вивчення циклічних водних кластерів (H2O)n та
кластерів аміаку (NH3)n (n = 1‑3).
Зроблено розрахунок структури молекулярних кластерів (H2O)n, де n = 2, 3, 4, 6, та
здійснено порівняння їх молекулярних параметрів між собою та з відповідними
параметрами для неасоційованої молекули H2O. Для структур (H2O)n з n = 3 – 6 розглянуто лише циклічні кластери [1]. Оптимізацію геометрії
всіх структур здійснено методом RHF у базисі aug-cc-pvdz з урахуванням MP2-кореляції [3].
Молекула води. За
даними розрахунків, довжина зв'язків О‑Н складає 0,966 Å, валентний
кут НОН – 103,7º.
Димер води. З отриманих даних видно, що утворення водневого зв'язку
найбільшою мірою позначається на зміні довжини зв'язку О-Н молекули-донора
протону (зміна становить 0,007 Å). В молекулі-акцепторі протону
також спостерігається незначне збільшення довжини зв'язку (0,001Å). Ці
зміни пояснюються перерозподілом електронної густини за рахунок утворення
водневого зв'язку. Слід звернути увагу також на незначне збільшення валентних
кутів (0,3-0,4º), що свідчить про збільшення s-характеру відповідних
гібридних орбіталей (sp3→sp2) в обох молекулах.
Довжина
водневого зв'язку в кластері дорівнює 1,959Å. Виграш в енергії при
утворенні кластеру 2 H2O ![]() (H2O)2 становить
21,74 кДж/моль.
(H2O)2 становить
21,74 кДж/моль.
Кут
фрагменту Н···О-Н дорівнює 170,20, тобто не відповідає строго
ідеальному для міжмолекулярного водневого зв'язку значенню 1800.
Тримери води. Для циклічного тримеру
(H2O)3 виявлено два потенціальних мінімуми, які
відрізняються відносною орієнтацією зв'язків О‑Н: в одному з них два зв'язки
орієнтовано з одного боку від площини атомів Оксигену, а третій – з іншого
боку; в другому – усі три зв'язки знаходяться з одного боку. Найбільш низьку
енергію має перший кластер; різниця в енергіях форм дорівнює 3,34 кДж/моль. Необхідно
зазначити, що обидва кластери мають практично трикутну форму з вершинами в
точках, що відповідають ядрам атомів кластеру. Атоми Гідрогену, які приймають
участь в утворенні водневого зв'язку мало відхиляються від лінії О-О. Валентні
кути О-Н···О становлять 149,10 ‑151,50, валентні кути Н-О···О –
89,60 – 88,80.
Довжини
водневих зв'язків в кластері А становлять 1,928Å, що на 0,03Å
коротше, ніж у кластері (H2O)2. Такий ефект, а також дещо
більший виграш в енергії в перерахунку на один водневий зв'язок (22,6 кДж/моль)
в порівнянні з (H2O)2, може бути пов'язаний частково з
реалізацією 6p‑електронної
квазіароматичної системи.
Енергія
окремої молекули води знижується зі збільшенням числа молекул води в кластері
до n » 10, при подальшому
збільшенні числа молекул води енергія практично не змінюється і дорівнює
приблизно 40 кДж/моль. Енергія водневого зв'язку в середньому мало залежить від
кількості молекул води в кластері й має величину, яка приблизно дорівнює 20‑35 кДж/моль
Молекула NH3. Довжина зв'язку в
ізольованій молекулі NH3 за даними розрахунків складає 1,020 Å,
а валентний кут H–N–H – 106.00.
Димер H2NH...NH3.
Довжина
водневого зв'язку в димері складає 2,29 Å, тобто дещо більше, ніж в
димері (H2O)2 (1,96 Å). Зміна енергії молекули при
утворенні водневого зв'язку складає –14,30
кДж/моль. Наслідком менших значень величин довжини водневого зв'язку в димері і
зміни енергії молекули при утворенні водневого зв'язку в порівнянні з димером
води є досить незначна зміна довжини зв'язків у вихідній молекулі NH3
(зміна довжини зв'язку складає +0,004 Å (порівняно з +0,007 Å для
(H2O)2).
Конформація
димеру (рис. 1), що відповідає мінімуму енергії дозволяє припустити внесок в
енергію кластеру поряд з електростатичною складовою також орбітальну, що
зумовлена обмінною взаємодією![]() з
з ![]() .
.
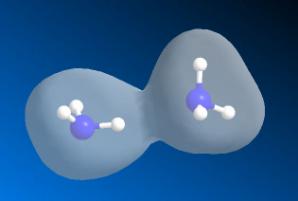
Рис. 1. Димер H2NH...NH3
Циклічний тример (NH3)3.
Розрахунки
показують, що відповідний тример за своєю геометрією практично не відрізняється
від циклічних тримерів (H2O)3, але валентний кут складає
в цьому випадку 171,20 проти ~1500, тобто тример аміаку більш схожий на трикутник. Відмінною
є також лише одна можливість розташування молекул NH3 в тримері
(проти двох таких можливостей в тримері (H2O)3), що
зумовлено наявністю лише однієї електронної пари в атомі Нітрогену та трьох NH-зв'язків.
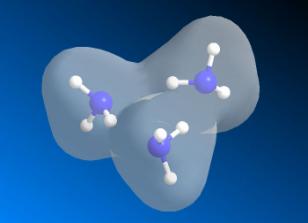
Рис. 2. Циклічний
тример (NH3)3
Таким чином, в тримері всі
електронні пари задіяні, а шість NH-зв'язків є вільними, тобто такий тример є
чистим протонодонором, на відміну від аналогічного тримера (H2O)3,
і не має можливостей утворювати шаруваті агрегати, що робить міжмолекулярну
взаємодію в молекулі аміаку менш ефективною.
Графік (Рис. 3) ілюструє зміну
енергії молекули аміаку від кількості молекул в кластері.
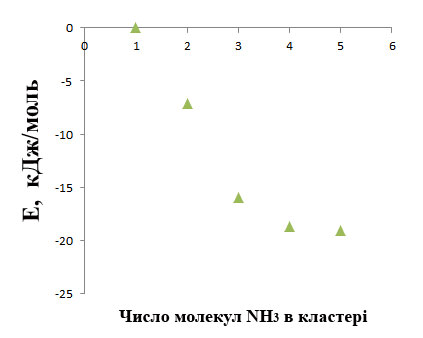
Рис. 3. Зміна енергії
молекули аміаку від кількості молекул в кластері
Крива виходить на насичення при
–19,06 кДж/моль, що менше, ніж в H2O, що відповідає природним
властивостям речовини, зокрема, нижчій температурі кипіння аміаку.
Використані джерела
[1]
Теоретичне вивчення циклічних водних кластерів H2ON (N = 1-6), а також кластерів
каркасної будови/ Цесарчук Н. С., Зайцева І. С. // Матеріали VIII Міжнародної
науково-практичної конференції "Научная индустрия европейского
континета - 2012", Прага, Чехія. Dil 20. – P. 46-51.
[2] Ab Initio Study of Ammonia
Clusters: (NH3)n (n = 2-6)/ H. Kandau, H. Sudrajat, A.
Napitupulu, S. Khairi, Z. Al-Fatony, H. Siagian // Indo. J. Chem. -Vol. 8. –No.
3. –P. 392-396 (2008).
[3] Alex A. Granovsky, Firefly
version 7.1.G,
www
http://classic.chem.msu.su/gran/firefly/index.html