Медицина/6.Экспериментальная и клиническая фармакология
асп.
Шаманаев А. Ю., к.б.н. Иванов И. С., д.б.н. Плотников М.Б.
ФГБУ «НИИ
фармакологии имени Е.Д. Гольдберга» СО РАМН, Томск, Россия
ГИПОЛИПИДЕМИЧЕСКАЯ АКТИВНОСТЬ
КОМПОЗИЦИЙ ДИГИДРОКВЕРЦЕТИНА И АРАБИНОГАЛАКТАНА
Нарушение липидного обмена является важным
фактором риска развития сердечно-сосудистых заболеваний, что связано со
значительным влиянием холестерина на развитие атеросклероза [8]. Несмотря на
достигнутые успехи в фармакотерапии гиперлипидемий, важной проблемой остается
профилактика и ранняя коррекция отклонений в метаболизме холестерина [6].
Наиболее перспективным решением данной проблемы может стать применение
антиоксидантов, благодаря их высокой биологической активности и широкому
спектру действия [1].
В проведенных исследованиях была
показана гиполипидемическая активность антиоксиданта дигидрокверцетина (ДГК) [3,
7]. С другой стороны, рядом авторов была продемонстрирована возможность
повышения фармакологической активности веществ, в том числе и
дигидрокверцетина, при использовании их в композиции с арабиногалактаном (АГ) [2,
5].
В связи с этим целью
работы явилось исследование гиполипидемической активности композиций
дигидрокверцетина и арабиногалактана.
Методика исследования. Эксперименты по
определению гиполипидемической активности проведены на 35 аутбредных крысах самцах
Wistar массой 300−350 г. Гиперлипидемию индуцировали введением тритона
WR-1339 (Sigma, USA) однократно внутривенно в дозе 250 мг/кг [4].
Исследуемые вещества вводили внутрижелудочно в виде суспензии в воде
очищенной в течение 7 суток: ДГК в дозе 50 мг/кг, композиция ДГК и АГ в
соотношении 1:3 в дозе 200 мг/кг (50 мг/кг+150 мг/кг), композиция ДГК+АГ 1:5 в
дозе 300 мг/кг (50 мг/кг+250 мг/кг), композиция ДГК+АГ 1:10 в дозе 550 мг/кг
(50 мг/кг+500 мг/кг) и АГ в дозе 250 мг/кг. Группы интактных и контрольных
животных получала эквиобъемное количество воды очищенной. Последнее введение
веществ осуществляли за 1 час до инъекции тритона WR-1339. Кровь для
исследования забирали у наркотизированных (диэтиловый эфир) животных из общей
сонной артерии через 8 часов после
введения тритона WR-1339. В плазме крови определяли триглецириды (ТГ), общий
холестерин (ХС), холестерин, связанный с липопротеидами высокой плотности
(ХС-ЛВП). Содержание холестерина, связанного с липопротеидами низкой плотности
(ХС-ЛПНП) рассчитывали по разнице между ХС и ХС-ЛВП.
Статистическую обработку результатов проводили с
использованием пакета статистических программ Statistica 6.0. В таблицах
представлены средние значения показателей и стандартные ошибки среднего
значения. Достоверность различий (р<0,05) между сериями определяли с помощью
Mann-Whitney U test.
Результаты исследования. У животных контрольной
группы содержание ТГ в плазме крови превышало значения показателя интактных
животных в 10 раз (рисунок). Все исследуемые вещества значимо снижали
содержание ТГ в плазме крови, однако наибольший эффект оказывали
дигидрокверцетин и композиция ДГК+АГ 1:3 (рисунок).
Содержание
ХС у контрольных животных также значительно возрастало (в 4,7 раза) по
сравнению с интактными (рис. 1). Дигидрокверцетин значимо снижал содержание ХС на
28%. Композиция ДГК+АГ 1:3 и композиция ДГК+АГ 1:5 показали тенденцию к снижению
уровня ХС, но эти различия не достигали уровня статистической значимости по
сравнению с контролем (рисунок).
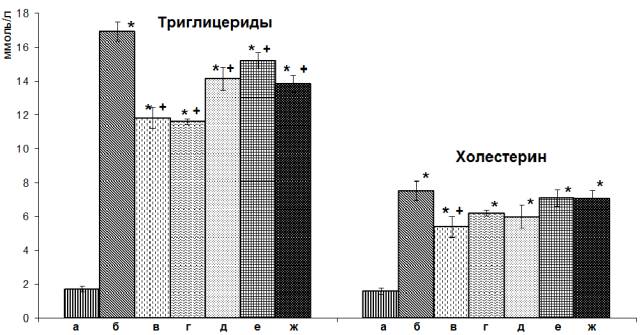
Рисунок. Содержание липидов в плазме крови у крыс с
гиперлипидемией, вызванной введением тритона WR-1339. * – р<0,05 по
сравнению с интактными, + – р<0,05 по сравнению с контролем; а – интактные, б –контроль, в – ДГК, г – ДГК+АГ 1:3, д – ДГК+АГ 1:5, е – ДГК+АГ 1:10, ж – АГ.
При
определении ХС-ЛВП в плазме крови животных в группах контроль и АГ было
выявлено достоверное уменьшение их содержания по сравнению с интактными на 30 и
40% соответственно. В остальных группах содержание ХС-ЛВП значимо не отличалось
от значений показателя у интактных животных.
Моделирование
гиперлипидемии приводило к увеличению содержания ХС-ЛПНП в плазме крови в 18
раз по сравнению с интактными животными. При этом ДГК, ДГК+АГ 1:3 и ДГК+АГ 1:5
достоверно снижали содержание ХС-ЛПНП на 34, 19 и 27% соответственно.
Выводы.
1.
Установлено, что гиполипидемическая активность композиций дигидрокверцетина и
арабиногалактана в соотношениях 1:3 и 1:5 не превышает активность
дигидрокверцетина в дозе, входящей с состав композиций.
2.
Выявлено, что с увеличением доли арабиногалактана в композиции с
дигидрокверцетином уменьшается гиполипидемический эффект последнего.
Литература:
1.
Деримедведь Л. В. Антиоксидантные
препараты в профилактике и лечении гиперлипидемий / Провизор. – 1999. –
№ 3. – С. 19–22.
2.
Душкин А.В. Композиция с повышенной фармакологической активностью на основе
дигидрокверцетина и растительных полисахаридов (варианты) / Патент РФ № 2421215. – 2010.
3. Колхир В.К., Тюкавкина
Н.А., Быков В.А. Дигидрокверцетин – новое антиоксидантное и
капилляропротекторное средство / Хим-.фар. журнал. – 1995. – Том 29, № 9. – С.
61–64.
4.
Руководство по
экспериментальному (доклиническому) изучению новых фармакологических веществ /
Под ред. Р.У. Хабриева. – М. : Медицина, 2005. – 832 с.
5.
Толстикова
Т. Г., Хвостов М. В., Брызгалов А. О. Арабиногалактан – растительный полисахарид
как новое средство для клатрирования фармаконов / Доклады академии наук. –
2010. – Том 433, № 5. – С. 713–714.
6. Larsen S., Stride N.,
Hey-Mogensen M. Simvastatin effects on skeletal muscle / J. Am. Coll. Cardiol. – 2013. – Vol. 61. № 1. – P. 44–53.
7. Theriault A., Wang Q.,
Van Iderstine S.C.,
Chen B., Franke A.A., Adeli K.
Modulation of hepatic lipoprotein synthesis and secretion by taxifolin, a plant
flavonoid / J. Lipid.
Res. – 2000. – Vol. 41, № 12. – P. 1969–1979.
8. Thompson G. R. Management of dyslipidaemia / Heart. – 2004. – Vol. 90, № 8. – P. 949–955.