Оналбаева Ж.С.
Восточно-Казахстанский
государственный технический университет
им. Д. Серикбаева, г.
Усть-Каменогорск, Казахстан
Современное состояние фторидной
технологии производства гидроксида бериллия из минерального сырья
В настоящее время существуют два промышленных
процесса производства гидроксида бериллия. В первом процессе бериллий
селективно извлекают спеканием берилла с фторсиликатом натрия с последующим
выщелачиванием водой (Копо-процесс). Во втором – Ве переводят в растворимое
состояние термической обработкой берилла, которая изменяет его кристаллическое
строение, что значительно упрощает вскрытие его серной кислотой. Из вскрытого
материала выщелачиваются бериллий и другие растворимые сульфаты. В
противоположность Копо-процессу, этот процесс совершенно неселективен и
требует последующего разделения бериллия и алюминия.
Описываемый способ был предложен Копо и
заключается в нагревании берилла с фторсиликатом натрия при 700–750 °С. Спекшийся материал обрабатывают
водой [1-11].
Процесс протекает по следующему уравнению
реакции:
|
3BeO·Al2O3·6SiO2
+ 6Na2SiF6 = 3Na2BeF4 + 2Na3AlF6
+ 9SiO2 + 3SiF4↑ |
(1). |
Из продуктов реакции в
воде растворим только фторбериллат натрия, что позволяет простым водным
выщелачиванием получать довольно чистые растворы. Улетучивание фторида кремния
нежелательно, так как при этом происходят потери фторирующего агента и
осложняется газоочистка. Потерю четырехфтористого кремния можно снизить
введением в шихту карбоната натрия, в результате образуется дополнительное количество
кремнефтористого натрия.
По предложенному
варианту процесс будет протекать по следующему уравнению реакции:
|
3BeO·Al2O3·6SiO2
+ 2Na2SiF6 + Na2CO3 = 3Na2BeF4
+ Al2O3 + 8SiO2 + CO2↑
|
(2). |
Изучение механизма спекания позволяет сделать
два важных вывода:
1)
необходимо
при спекании сохранить тетрафторид кремния, так как при разложении
кремнефтористого натрия образующийся фторид натрия способствует нежелательному
образованию альбита и, кроме того, непроизводительно теряется фтор;
2)
из-за
нежелательных вторичных процессов необходимо проводить спекание при 750 °С в
течение не более 2 часов.
Основным недостатком фторидного способа является
потеря дорогостоящего фтора при последующем осаждении гидроксида бериллия из
фторидного раствора по уравнению реакции:
|
Na2BeF4
+ 2NaOH = Be(OH)2 + 4NaF |
(3). |
Технологическая схема переработки концентрата по
фторидному способу приведена на рисунке 1. Берилловый концентрат измельчают на
щековой дробилке, а далее в мельнице мокрого помола, работающей в замкнутом
цикле со спиральным классификатором. Для отделения слива пульпу фильтруют на
барабанном фильтре. Измельчённый концентрат смешивают в мельнице-смесителе с
фторирующими реагентами и содой. Полученную хорошо перемешанную шихту
брикетируют, а затем сушат и спекают брикеты в туннельной печи. При этом
происходит фторирование берилла, и Ве переходит в водорастворимое соединение.
Спек, после охлаждения, дробят, измельчают мокрым способом и направляют на
выщелачивание водой. Бериллий в виде фторида или натрийфторбериллата переходит
в pacтвop. Эта операция весьма селективна: раствор практически не содержит
никаких элементов, кроме натрия, бериллия и фтора. Растворы фторобериллата
натрия после выщелачивания содержат не значительные примеси алюминия, железа и
кремния, поэтому специальной очистки их от примесей не требуется, и осаждение
технического гидроксида бериллия едким натром ведут непосредственно из
растворов от выщелачивания в соответствии с реакцией (3). Осаждение без избытка
едкого натра обеспечивает почти количественное осаждение бериллия.
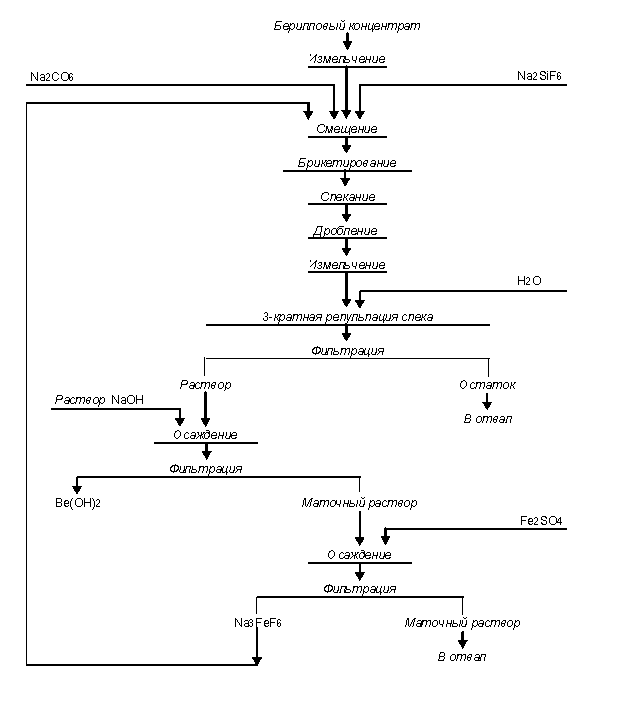 Рисунок
1 – Технологическая схема переработки бериллового концентрата по фторидному
способу
Рисунок
1 – Технологическая схема переработки бериллового концентрата по фторидному
способу
К концу взаимодействия образуется
гранулированный гидроксид бериллия и раствор фторида натрия. Отжатую и отмытую
на рамном фильтре гидроксид сушат и прокаливают при 1000 °С во вращающейся
печи с наружным обогревом. Общее извлечение бериллия из концентрата составляет
85 %. Примерный состав такого оксида бериллия следующий, % масс.: 97,7 BeO; 1,2
SiO2; 0,7 Al2O3+Fe2O3;
0,18 Na2SO4.
Описанный выше способ в данное время в
промышленности не приме-няется из-за таких недостатков как низкая экологическая
безопасность технологического процесса, дороговизна реагентов и сложность аппаратурного
оформления [1-11].
Литература:
1. Силина Г.Ф., Зарембо
Ю.И., Бертина Л.Э. Бериллий, химическая технология и металлургия. – М.:
Атомиздат, 1960. – 120 c.
2. Уайт Д., Берк Дж.
Бериллий. – М.: ИЛ, 1960. – 616 c.
3. Дарвин Дж., Баддери
Дж. Бериллий. – М.: ИЛ, 1962. – 324 c.
4. Химия и технология редких и рассеянных элементов: В
2 т. / Под ред. К.А. Большакова.
– Т. 2: Технология редких и рассеянных элементов. – М.: Высшая школа, 1969. –
640 c.
5. Хлебникова Е.Н. Определение физико-химических характеристик минералов бериллия и лития, и
выбор оптимальных условий их вскрытия в гидрометаллургии: Дис. … магистра техн. наук. Усть-Каменогорск, 2013. – 87 с.
6. Зеликман А.Н.,
Меерсон Г.А. Металлургия редких металлов. – М.: Металлургия, 1973. – 608 c.
7. Зеликман А.Н.,
Коршунов Б.Г. Металлургия редких металлов. – М.: Металлургия, 1991. – 432 с.
8. Самойлов В.И. Экспериментальная разработка перспективных
химических методов извлечения бериллия и лития из минерального сырья. –
Усть-Каменогорск: Медиа-Альянс, 2006. – 551 с.
9. Самойлов В.И., Борсук А.Н. Методы совместной переработки
фенакита, бертрандита и берилла в гидрометаллургии бериллия. –
Усть-Каменогорск: Медиа-Альянс, 2006. – 200 с.
10. Коленкова М.А., Крейн О.Е. Металлургия рассеяных и
легких редких металлов. – М.: Металлургия, 1977. – 360 с.
11. Химическая технология и металлургия бериллия и его
сплавов: Сб. переводов / Под ред. М.Б. Борисова. – М.: ИЛ, 1953. – Ч. I. – С.
5-25.