УДК
581.1
А.П. Кравченко, О.В. Булгакова,
Р.И. Берсимбаев
Научно-исследовательский институт клеточной биологии и биотехнологии
Евразийского национального университета им. Л. Н. Гумилева (г. Астана,
Казахстан)
Влияние мутации в AtRaptor гене на экспрессию генов фермента альдегидоксидаза
у Arabidopsis thaliana
Модуляция
роста и развития обеспечивается сложной сетью биохимических процессов и
сигнальных путей во всех организмах. TOR сигнальный
путь является одной из основополагающих сигнальных систем в клетках
эукариотических организмов. TOR (англ. Тarget of Rapamycin)
киназа выступает в качестве центрального компонента этой сигнальной системы в животных
клетках и является частью двух различных мультибелковых комплексов, а именно: TORC1 и
TORC2,
которые регулируют рост и размер клеток, активируя множество анаболических
процессов, связанных с биогенезом органелл, включая биосинтез белков и липидов
[1,2].
Различные
манипуляции с компонентами ТОR комплекса у Arabidopsis
thaliana указывают на общую роль TOR сигнального пути в качестве основного
регулятора белкового синтеза и метаболизма, а также его участие в других
биологических процессах, таких как эмбриогенез, активация меристем, рост корней
и листьев, цветение и старение[3-5].
Некоторые
партнеры ТOR
комплекса 1 были идентифицированы у растений, в том числе у Arabidopsis thaliana имеются консервативные последовательности TOR киназы(AtTOR) и
по два гомолога LST8 (AtLST8-1 и AtLST8-2) и RAPTOR (AtRaptor1 и AtRaptor2) белков [6-9].
Несмотря на последние
открытия, на сегодняшний день остаются малоизученными взаимоотношения TOR
сигналинга с метаболизмом фитогормонов. Как известно, фермент альдегидоксидаза
участвует в биосинтезе двух гормонов: абсцизовой кислоты и индол-3-уксусной
кислоты, которая принадлежит к семейству ауксинов[10, 11].
В модельном растении Arabidopsis thaliana альдегидоксидазу кодируют четыре гена AAO1-AAO4,
образующие гомо- и гетеродимеры с различной
субстрат-специфичностью[12, 13].
У Arabidopsis thaliana были
идентифицированы две гомодимерные изоформы белков AAO1 и AAO2 и гетеродимер AAO1/AAO2. Гомодимер AAO1 окисляет
индол-3-ацетальдегид до индол-3-уксусной кислоты с высокой эффективностью[13]. Как
известно, индол-3-уксусная кислота принадлежит к семейству ауксинов, что
предполагает возможную физиологическую роль альдегидоксидазы в биосинтезе
растительного гормона ауксина.
Кроме
того, был обнаружен еще один гетеродимер, состоящий из AAO2 и AAO3 мономеров,
характеризующийся высокой специфичностью к абсцизовому альдегиду - предшественнику
растительного гормона абсцизовой кислоты (AБК), которая участвует во многих
аспектах роста и развития растений, в
том числе прорастание семян, вегетативный рост, а также адаптация к различным
стрессам окружающей среды[11, 12].
Ввиду того, что
альдегидоксидаза катализирует различные окислительно-восстановительные реакции
и участвует в процессах биосинтеза фитогормонов в растениях, целью настоящей работы было изучение
влияния мутации в гене AtRaptor, кодирующего белок-партнер
TOR
комплекса 1 у растений, на экспрессию генов фермента альдегидоксидаза у Arabidopsis thaliana в
нормальном физиологическом состоянии и при воздействии солевого стресса.
В экспериментах были
использованы растения дикого типа Col-8 Arabidopsis
thaliana и
мутантной линии SALK_022096,
содержащие вставку Т-ДНК в 14 экзоне гена AtRaptor1 (At3g08850).
При наблюдении за ростом и морфологическими свойствами
растений A.thaliana дикого типа и мутантной линии rap22 на 10-й день роста были отмечены отличия в
вегетативном росте. Как видно из представленных на рис. 1 данных, по сравнению
с диким типом Arabidopsis у
растений линии lst8-1 наблюдается
задержка развития листовых пластинок.

Рисунок 1. Фенотипические особенности растений A.thaliana мутантной линии rap22. WT - дикий тип; rap22- мутантная линия.
Экспрессия
генов определялась с помощью количественной полимеразной цепной реакции в
режиме реального времени с использованием флуоресцентного ДНК-связывающего
красителя SYBR® Green и специфичных праймеров.
Как
показано на рисунке 2, экспрессия гена AAO1 в 2.5 раза ниже у мутантной
линии rap22, тогда как уровень
транскриптов AAO3 гена в 3.5 раза выше в сравнении с диким
типом(WT).
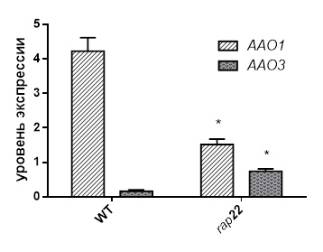
Рисунок 2.
Экспрессия генов AAO1 и AAO3, кодирующих фермент альдегидоксидаза,
у растений A.thaliana дикого
типа (WT) и мутантной линии rap22.
На
основании полученных результатов можно заключить, что в условиях снижения
активности TOR
комплекса наблюдается существенное снижение экспрессии гена ААО1 и повышение
уровня транскриптов ААО3 гена. Гены AAO1 и AAO3 кодируют изоформы фермента
альдегидоксидазы, участвующие в заключительных стадиях биосинтеза гормонов
семейства ауксинов и абсцизовой кислоты, соответственно. В связи с
вышеизложенным планируется проведение экспериментов по определению содержания
ауксина и абсцизовой кислоты у мутантной линии rap22. Таким образом, можно
предположить, что TOR сигналлинг
может выступать в качестве регулятора биосинтеза двух основных гормонов
растений АБК и ауксина.
В целом, однако,
естественно предполагать, что TOR сигнальная система
растений может вступать в сложные регуляторные взаимодействия с АБК и ауксин
гормональными системами не только посредством альдегидоксидазы, но и других
ферментных систем.
Литература:
1. Wullschleger
S., Loewith R., Hall M. TOR signaling in growth and metabolism // Cell. 2006.
Vol.124. P.471–484.
2. Берсимбай
Р.И., Булгакова О.В.,Омаров Р.Т.,Сарбасов Д. Роль mTOR сигнальной системы в регуляции клеточных
функций // Доклады НАН РК. 2010. №5. С. 82-90.
3. Anderson G. TOR
signaling in plants // Plant Cell Monographs. 2008. Vol.10. P.243-259.
4. John F.,
Roffler S., Wicker T., Ringli C. Plant TOR signaling components // Plant
Signalling and Behavior. 2011. Vol 6. N.11. P. 1700-1705.
5.
Moreau M., Sormani R.,
Menand B.,Veit B., Robaglia C., Meyer C. The
TOR complex and signaling pathways in plants // Enzymes. 2010. Vol.27.
P.285-302.
6.
Moreau M., Azzopardi M., Clement J., Dobrenel T., Marchive
C., Renne C.,Martin-Magniette M.L., Tacconat L., Renou J.P., Robaglia C., Meyer
C. Mutations in the Arabidopsis homolog of LST8/GβL, a partner of the
target of Rapamycin kinase, impair
plant growth, flowering, and metabolic adaptation to long days // Plant Cell .2012. Vol.24. P. 463-481.
7.
Deprost D., Yao L.,
Truong H., Robaglia C. and Meyer C. An
Arabidopsis homolog of RAPTOR/KOG1 is essential for early embryo development
// Biochemical and Biophysical Research
Communications. 2005. Vol. 326. P. 844–850.
8.
Anderson G., Veit B. and Hanson M. The Arabidopsis AtRaptor
genes are essential for post-embryonic plant growth // BMC Biology. 2005. Vol.3
P.144–153.
9.
Menand B., Desnos T.,
Nussaume L., Berger F., Bouchez D., Meyer C., Robaglia C. Expression and
disruption of the Arabidopsis TOR (target of rapamycin) gene // Proc Natl Acad
Sci USA. 2002. Vol.99. P. 6422–6427.
10.
Seo M., Akaba S.,Oritani T.,
Delarue M., Bellini C., Caboche M., and Koshiba T. Higher activity of an aldehyde oxidase in
the auxin-overproducing superroot1mutant of Arabidopsis thaliana // Plant
Physiol. 1998. Vol. 116. P.687–693.
11.
Seo M., Peeters A.J., Koiwai H., Oritani T., Marion-Poll A.,
Zeevaart J.A., Koornneef M., Kamiya Y., Koshiba T. The Arabidopsis aldehyde oxidase 3 (AAO3) gene product
catalyzes the final step in abscisic
acid biosynthesis in leaves // Proc Natl Acad Sci USA. 2000. Vol. 97. P.12908–12913
12.
Koiwai H., Nakaminami K., Seo M., Mitsuhashi W., Toyomasu
T., Koshiba T. (2004) Tissue-specific
localization of an abscisic acid biosynthetic
enzyme, AAO3, in Arabidopsis // Plant Physiol. 2004. V.134. P.1697–1707
13.
Akaba S., Seo M., Dohmae N., Takio K., Sekimoto H., Kamiya
Y., Furuya N., Komano T., Koshiba T. Production
of homo and hetero-dimeric isozymes
from two aldehyde oxidase genes of
Arabidopsis thaliana // J Biochem. 1999. Vol.126. P.395–401.
14.
Xiong Y., Sheen J. The role of target of
rapamycin signaling networks in plant growth and metabolism // Plant Physiol. 2014.
Vol. 164. P. 499–512.