Аспетов ДР., Омарова М.Н., Оракбай Л.Ж.,
Жуматова Б.Х., Шакетова Н.Т.
Научный центр гигиены и
эпидемиологии им. Хамзы Жуматова, Алматы
ИЗУЧЕНИЯ ВЛИЯНИЯ ФОСФОРОРГАНИЧЕСКОГО
ПЕСТИЦИДА НА ПРОДУКЦИЮ ИНТЕРФЕРОНА КЛЕТКАМИ ЧЕЛОВЕКА
В настоящее
время пестициды относят к группе лидеров среди экзогенных загрязнителей
биосферы [1]. Экспериментально-клинические наблюдения показывают, что действие
пестицидов в малых дозах провоцирует
возникновение различных заболеваний в отдельных органах, системах и организме в
целом, повышая заболеваемость
гепатитом, болезней органов дыхания и пищеварения, сердечно-сосудистой и
нервной системы и гинекологическими патологиями [2,3].
Влияние пестицидов
на активность различных компонентов
иммунной системы, в частности, цитокинов, изучено недостаточно. Цитокины –продукты секреции иммунокомпетентных клеток организма представляют собой группу гормоноподобных
белков и пептидов, регулирующих межклеточные взаимодействия. Благодаря
цитокинам регулируются согласованные действия иммунной, эндокринной и нервной
системы в нормальных условиях и в ответ на патологические воздействия[3]. Важнейшей
системой цитокинов, участвующей в иммунологической защите организма против инфекций, токсинов и других чужеродных воздействий на организм является система
интерферона, которая представлена
группой низкомолекулярных белков-гликопротеидов, обозначенных символами
α/β и γ-
и являющихся продуктом секреции
иммунокомпетентных клеток. Подавление функциональной активности клеток,
вырабатывающих интерфероны, способствует
возникновению вторичной иммунной недостаточности, развитию бактериальных осложнений [4].
Данных по
влиянию фосфорорганического пестицида нового поколения - глифосата на систему интерферона в доступной литературе
мы не обнаружили.
Цель исследований. Изучить
действие фосфорорганического пестицида (гербицида) глифосата
(ГФ) на способность клеток к
продукции α/β- интерферона (ИФН) на модели перевиваемой линии
клеток человека RD.
Материалы и методы. В работе
использовали перевиваемые клетки
человека линии RD. Клетки выращивали в
96-луночных луночных пластиковых
планшетах фирмы «BD Falcon» в среде 199 с 10% телячьей эмбриональной сывороткой (ТЭС). Посевная доза составляла 104
кл/лунка. Планшеты помещали в камеру, содержащую 5% СО2, при
температуре 37°С. Вирусы: ВБН – вирус
болезни Ньюкасла – индуктор интерферона.
В качестве индикаторного тест- вируса использовался вирус
энцефаломиокардита мышей ЭМК. За единицу активности ИФН (ед/мл) принимали
величину, обратную его максимальному разведению, которое защищало 50% клеток от
действия 100 ТЦД50/мл ( тканевых цитопатогенных доз) вируса ЭМК. В
качестве контроля использовали референс препарат ИФН для перевода полученной
активности в международные единицы (МЕ).
Статистическую обработку проводили с применением программы Statistica. [5]. Определялось среднее
арифметическое (М) и стандартное отклонение
(m).
Результаты Определение минимальной концентрации ГФ, вызывающей
50% цитотоксическое действие (ЦД50
) на клетки RD
проводили микрометодом в 96-
луночных планшетах. В лунки с с монослоем клеток вносили разведения ГФ в ростовой среде в присутствии 10% ТЭС,
начиная от 1:500 (0,05 мг/1,0 мл ) и
далее 1 :1000, 1:2000, 1:4000, 1:8000, 1: 16000, 1: 32000. В контрольные лунки
вносили ростовую среду, не содержащую
ГФ. Клетки помещали в термостат
при t 37°С в камере с 5% СО2.
За состоянием монослоя в течение наблюдали под контролем инвертированного
микроскопа в течение 12, 24, 48, 72
часов. На момент окончания эксперимента
в монослое культуры клеток в контрольных лунках в дегенерации
не наблюдалось. Нами было отмечено, что уже в первые 12
часов в монослое опытных клеток, обработанных
ГФ в разведении 1:500 и 1: 1000
наблюдалась округление клеток под действием ГФ, свидетельствующее о дегенеративных
изменениях в клеточном монослое. В разведении ГФ 1:1000 наблюдалось
ощелачивание ростовой среды опытных клеток, свидетельствующее о снижении
их жизнеспособности, в сравнении с неизмененными клетками в
контроле. В клетках с разведениями ГФ
1: 2000 монослой клеток частично сохранился. Начиная с разведения ГФ 1: 4000
и выше до 1:32000 состояние
клеток в монослое оставалось без
изменений.
В дальнейших исследованиях применялось исходное разведение ГФ 1: 5000 (0,005мг/мл), не
оказывающее видимого цитотоксического
действия на клетки при сохранении их способности
к продукции интерферона.
Изучение действия ГФ
на продукцию – α/β интерферона клетками человека RD в
зависимости от времени контакта.
Перевиваемые
клетки человека линии RD выращивали в
96 луночных пластиковых панелях. На сформировавшийся монослой наносили по 0,005
мг/мл ГФ, растворенного в среде 199 с 10% ТЭС и помещали в термостат при t 37°С в СО2 -камере
на 24 часа. Затем среду, содержащую ГФ, удаляли, клетки дважды отмывали
средой 199 и вносили по 105,5 lg вирус-индуктор ИФН-
ВБН, после чего панели с клетками
инкубировали при t 37°С в СО2-
камере 24 часа. Пробы культуральной среды отбирали и после обработки тестировали
в них активность ИФН. Результаты показали, что контрольные клетки, не
подвергшиеся воздействию ГФ в течение 5 суток наблюдения продуцировали ИФН с,
практически, одинаковой активностью 280±31,8 – 228 ±14,6 ед/мл). На этом фоне клетки
RD, обработанные ГФ в течение
2-3 суток, полностью утратили
способность продуцировать интерферон.
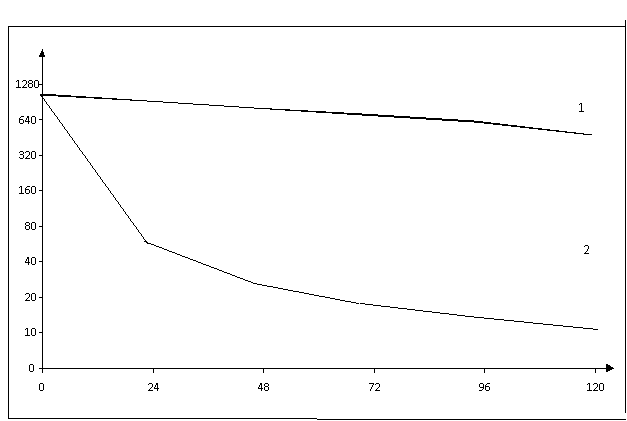

Рисунок 1.
Влияние глифосата на интерфероногенез в клетках RD, индуцированных вирусом ВБН,
в зависимости от времени контакта ГФ
На монослой
клеток RD, выращенных в 96- луночных планшетах вносили по 0,005 мг/мл ГФ после чего клетки выдерживали при t +37°С, в СО2- камере
в течение 24, 48, 72, 96, 120 часов. Затем питательную среду из лунок отбирали,
монослой отмывали средой 199 и вносили в лунки по 5,5 lg
ЭИД5 вирус –индуктор ВБН.. Планшеты помещали при t +37°С на 24 ч, после чего пробы
из лунок собирали, обрабатывали и
испытывали на активность α/β-интерферона.
Результаты титрования представлены на рисунке 1. Они показывают, при контакте ГФ с клетками в течение
24 часов продукция ИФН снижалась с 960±84,6 ед/мл в контроле до 53±12,4
ед/мл. Дальнейшая инкубация клеток с ГФ приводила к последовательному
уменьшению титров ИФН. В пробах, взятых через 120 часа активность ИФН составила 14±1,3 ед/мл.
Влияние различных концентраций ГФ на продукцию α/β –интерферона, клетками RD, индуцированных вирусом ВБН.
В 96-луночные
планшеты вносили перевиваемые
клетки RD
в посевной дозе 1х104 клеток/мл
в среде 199 с 10% ТЭС. Планшеты помещали в термостат при t 37°С в
СО2 – камере на 24
часа. На сформировавшийся монослой наносили различные концентрации ГФ от 0,00002 до 0,005 мг/мл в среде 199 и выдерживали при t 37°С в течение 24 часов, после чего ГФ-
содержащую среду удаляли. Монослой
клеток дважды промывали, затем в
лунки вносили по 5,5 lg ЭИД50 вируса
ВБН.
После
дополнительной инкубации панелей с клетками в термостате в течение 24 часов,
пробы поддерживающей среды из лунок
собирали, обрабатывали и определяли в
них активность α/β- интерферона.
На
рисунке 2 представлены результаты
титрования ИФН. Они показывают, что контрольные клетки, не подвергшиеся
контакту с ГФ, продуцировали α/β-интерферон с активностью 960±18,05 ед/мл. Наименьшая концентрация ГФ,
взятая в опыт – 0,00002 мг/мл,
приводила к подавлению процесса образования ИФН до 485±21,0 ед/мл. Повышение концентрации ГФ влияло на
продукцию ИФН: с увеличением концентрации
ГФ, воздействовавшего на клетки, параллельно
проявлялось его ингибирующее влияние на продукцию ИФН. Доза ГФ, взятая в исходной концентрации – 0,005 мг/мл, не вызывающей
цитотоксического действия, подавляла
продукцию ИФН до 12±,1,4 ед/мл.
Влияние длительного воздействия глифосата на клетки RD
На монослой клеток RD, выращенных в пластиковых панелях вносили по 50 мкг/мл ГФ. Клетки
инкубировали при t 37°С в СО2 -камере в течение 24, 48, 72, 96, и 120 часов. Затем ГФ
содержащую среду удаляли, отмывали и
вносили по 5,5 lg вирус-индуктор ВБН. Через 24 часа из лунок
пробы из лунок собирали, обрабатывали и
тестировали на содержание ИФН.
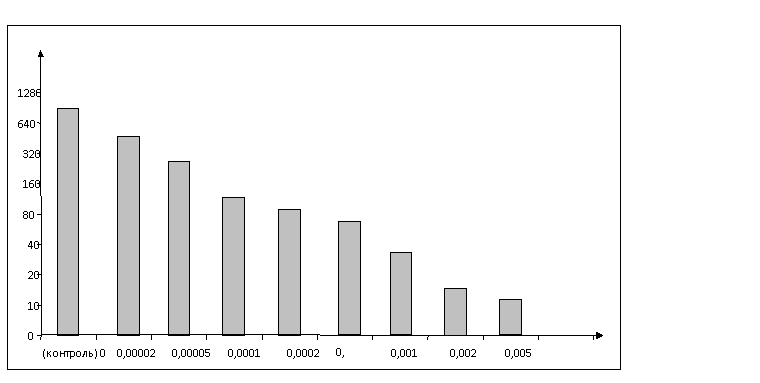

Рисунок 2 –
Действие различных концентраций глифосата на продукцию интерферона в клетках человека
RD.
Результаты
представлены на рисунке 3. Они показывают, что с увеличением продолжительности
воздействия ГФ на клетки увеличивалось ингибирующее влияние ГФ на продукцию
ИФН.
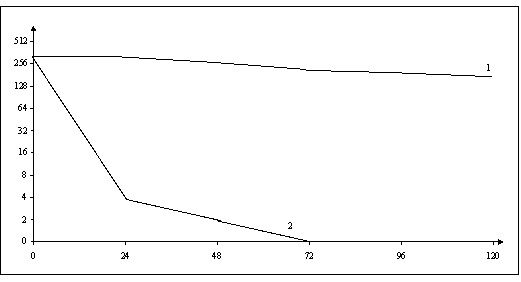
1 - титры интерферона в контрольных пробах;
2 - титры интерферона в пробах клеток предварительно
обработанных ГФ.
Рисунок 3.
Активность интерферона в клетках RD
Клетки,
обработанные ГФ в течение 2-3 суток, полностью
утратили способность продуцировать интерферон. Контрольные клетки, не
подвергшиеся воздействию ГФ в течение 5 суток наблюдения продуцировали ИФН с,
практически, одинаковой активностью 280±31,8 – 228 ±14,6 ед/мл).
Известно,
что клетки клетки лейкоцитарного и липидного спектров крови наиболее чувствительны к воздействию
пестицидов [1,2]. В этой связи актуальной проблемой является изучение
действия пестицидов и продуктов их трансформации в тканях и органах человека [7].
Результаты
проведенных исследований показали, что пестицид глифосат оказывает ингибирующее
действие на продукцию α/β - ИФН
клетками человека в концентрации,
не вызывающей цитотоксического действия клетки (0,005мг/мл) более, чем в 2
раза. Увеличение
дозы пестицида, а также времени его контакта с клетками приводит к
прямопропорциональному снижению
активности выработки ИФН: с 960±18,05
ед/мл в контроле клеток без ГФ и до 485±21,0 ед/мл в опытных клетках, обработанных ГФ.
В
наших опытах воздействие глифосата на клетки
в дозе 0,05 мг/мл течение 120 часов вызывало полное падение продукции ИФН через
48-72 часа, что, по- видимому, связано с явлением функциональной кумуляции препарата, вызывающее токсический
эффект, когда происходит суммирование не самого яда, а его следовых реакций [8].
Проведенные
исследования свидетельствуют о необходимости установления систематического
контроля за определением остаточного содержания пестицидов в продуктах питания,
объектах внешней среды и активного поиска средств преодоления токсического
воздействия этих химикатов на организм.
Список
литературы.
1
Домшлак М.Г., Макарова-Землянская Е.Н.
// Медицина труда и промышленная экология. – 2009. -№ 10. – С.45 – 48.
2.Панина
Н.К. Лабораторный контроль за остаточным количеством пестицидов в окружающей
среде // Гигиена и санитария. -2010.- № 3. – С.77- 80.
3 Справочник
по пестицидам (гигиена применения и токсикология) / Под ред. Клетки,
обработанные ГФ в течение 2-3 суток, полностью
утратили способность продуцировать интерферон. Контрольные клетки, не
подвергшиеся воздействию ГФ в течение 5 суток наблюдения продуцировали ИФН с,
практически, одинаковой активностью 280±31,8 – 228 ±14,6 ед/мл).
Л.И.Медведя.
– Л., 1997.
4 Кремлева
Е.А., Черкасов С.В. Продукция цитокинов вагинальными эпителиоцитами в процессе
взаимодействия с доминантными и ассоциативными микросимбионтами //
Журн.микробиол., эпидемиол. и иммунобиол.- 2012 . - № 4. – С.114-118.
5 Кареткина Г.Н.
Применение индукторов интерферонов для лечения и профилактики гриппа и других
острых респираторных вирусных инфекций // Лечащий врач. - № 10. – 2009. – С.
36-41.
6.Реброва О.Ю. Статистический анализ медицинских
данных. Применение пакета прикладных программ Statistica. М., 2006.
7 Мельников
Н.Н. Пестициды – химия, технология,
применение. – .-1990
8
Методы гигиенической и токсикологической оценки биологического действия
пестицидов. М., Медицина, 1977, С .36-37.