Химия и химические технологии/7. Неорганическая химия
К.х.н. Пожидаева С.Д., аспиранты
Елисеева А.Ю., Сотникова Д.А., Макеева Т.В., студенты Лазарева В.А., Теплова Т.А,
д.х.н. Иванов А.М.
Юго-Западный
государственный университет, Россия
Металлы как гетерогенные
восстановители соединений меди (II) в различной
степени минерализованных водных растворах кислот.
Известно [1-5], что при интенсивном
механическом перемешивании (лопастная мешалка 3000 об/мин) соли меди (II)
легко окисляют медь и различные марки бронз и латуней, причем не только в
мелкораздробленном состоянии, но и в виде деталей, приводя к полному разрушению
последних в течение довольно короткого времени воздействия (несколько более
1000-1500 мин). Здесь важно то, что в основные и средние соли (олово преимущественно
в оксид металла (II)) переходит не только медь, но и все
другие входящие в состав её сплавов металлы.
Высокие, а иногда и
аномально высокие скорости расходования меди объяснены наличием и эффективным
функционированием циклической макростадии [1], в которой металл окисляется
соединением меди (II) с образованием соединений меди (I), а
последние довольно легко окисляются молекулярным кислородом (кислородом
воздуха) в соединения меди (II), тем самым восстанавливая
запасы израсходованного на взаимодействие с металлом окислителя.
Тот факт, что в таких же
условиях и с соизмеримыми скоростями легко расходуются и сплавы меди можно
расценить как определенный довод в пользу функционирования аналогичной
циклической стадии с участием входящих в состав сплавов металлов (Ме), что
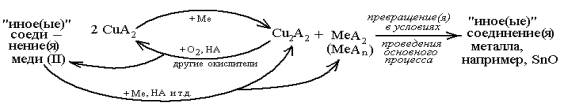
схематически можно изобразить как (HA – кислота):
|
|
(1) |
Представляло интерес подтвердить либо
опровергнуть обозначенное предположение. Некоторые из полученных данных
приводятся ниже.
Эксперимент проводили в
соответствии с пооперационной схемой, представленной на рис. 1. Данные о верхних
границах диапазонов скоростей расходования изученных металлов и сплавов меди
приведены в табл.
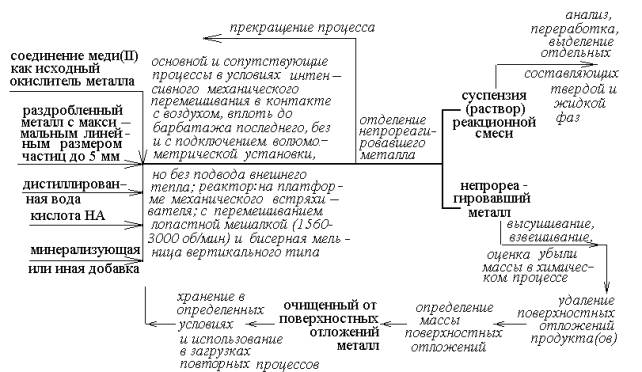
Рис.1
– Пооперационная схема проведения процесса
Таблица - Достигнутые верхние границы диапазонов
скоростей расходования металлов (сплавов)
|
Металл или сплав |
W, |
Металл |
W, |
|
Медь |
850 |
олово |
240 |
|
Бронза |
920 |
свинец |
370 |
|
Латунь |
615 |
марганец |
540 |
|
Цинк |
470 |
железо |
330 |
|
Алюминий |
360 |
|
|
Хорошо видно, что достигнутые скорости для отдельных
металлов в части верхних границ диапазонов соизмеримы между собой. Тем не менее,
на основе этих данных вывод об эффективном функционировании обозначенных выше
стадий кажется преждевременным.
Дело в том, что среди приведенных
металлов есть такие, которые довольно легко должны реагировать с кислотами
(даже со слабыми карбоновыми) с образованием соли и водорода, в частности,
например (НА – одноосновная кислота)
Zn
+2HA → ZnA2 + H2 (2)
Важно было хотя бы
приблизительно учесть вклад этой реакции в расходование металла в выбранных
условиях эксперимента. С этой целью была предпринята попытка провести процесс в
отсутствии медьсодержащего окислителя (рис.2) и снять кинетику выделения водорода с использованием
волюмометрической установки. В качестве рабочей кислоты была выбрана HCOOH, а металла Zn.
|
|
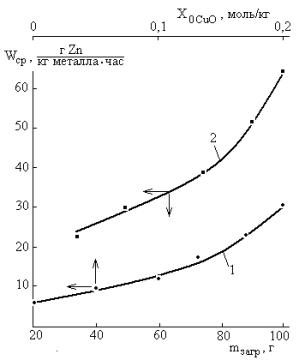
Рис.2 – Средняя в течение 5 часов скорость
расходования цинка в зависимости от начальной дозировки оксида меди (II)
при загрузке реакционной смеси 50 г и мольном соотношении оксид: муравьиная
кислота 1:2 (1), а также во взаимодействии с 0,4 моль/кг муравьиной кислоты и
0,2 моль/кг оксида меди (II) в водном растворе
хлорида аммония (0,25 моль/кг) в зависимости от массы загрузки при
соотношении с массой стеклянного бисера 1:1 (2); масса загруженного цинка 30
г, скорость вращения лопастной мешалки 1440 об/мин, температура 20±1°С |
Хорошо видно, что при небольших
начальных содержаниях CuO
скорость взаимодействия (2) вполне соизмерима со скоростью брутто-процесса в
целом. Но при ![]() >0,1 моль/кг
различия автоускорено нарастают и при
>0,1 моль/кг
различия автоускорено нарастают и при ![]() =0,2 моль/кг скорость брутто-процесса уже примерно в 5 раз
превышает величину в отсутствии оксида меди (II).
=0,2 моль/кг скорость брутто-процесса уже примерно в 5 раз
превышает величину в отсутствии оксида меди (II).
Выполнить поставленную задачу с
волюметрической установкой также оказалось не так уж и просто. Вначале
выделение водорода фиксируется довольно четко. Но во времени скорость его постоянно
падает и к 30-35 мин становится близкой к нулю. Если волюмометрическую
установку разгерметизировать и газовое пространство продуть воздухом, а затем
продолжить процесс, описанная выше картина в целом повторится вновь. Дальнейшие
исследования показали, что в данном случае волюмометрическое измерение фиксирует
два противоположно направленных процесса, а именно выделение водорода по
реакции (2) и поглощение кислорода воздуха на окисление соединений меди (I) в соединения меди (II). В первый момент, когда
соединений меди (I)
нет совсем или же очень мало, удается зафиксировать практически только взаимодействие
(2), что дает возможность оценить величину его скорости в выбранных условиях и
полученную величину сравнить с данными табл. в аналогичных условиях для
обозначенного металла, а также начальной точки кривой 1 рис. 2. Получается
хорошее совпадение с данными кривой (1) рис.2. Это можно расценить в пользу
наличия эффективного функционирования циклической макростадии (1). Роль
последней может быть увеличена, если процесс проводить в присутствии барботажа
воздуха: средняя скорость расходования металла в зависимости от условий проведения
процесса растет в 1,5-4 раза. Можно говорить и о том, что рассматриваемая
макростадия на основе соединений меди (II) вполне конкурентноспособна с изученной
ранее макростадией с участием молекулярного йода в качестве окислителя металла [5].
Что
же касается реакции (2), то её вполне можно рассматривать как сопутствующий,
параллельно протекающий и в какой-то степени сопряженный процесс. Последнее в
определенной степени связано с блокировкой поверхности продуктами превращения:
при наличии параллельной циклической макростадии деблокировка поверхности
металла может происходить гораздо быстрее и эффективнее. Правда не всегда.
Важное значение имеют
концентрационные соотношения реагентов и условия проведения рассматриваемых
процессов. Примером могут служить данные рис. 2. Обращает на себя внимание
довольно сильный, причем автоускоренный, рост величины средней скорости
расходования цинка с увеличением массы загрузки (кривая (2)), а также с увеличением
начального содержания CuO как исходного
медьсодержащего окислителя (кривая (1)). При этом во втором случае рост менее
интенсивный, чем в первом. Для объяснения последнего следует обратить внимание
на балансовые соотношения. В частности в последней точке кривой (2)
расходовалось 0,125 молей металла при загрузке кислоты 0,04 моля и оксида меди
0,02 моля. Естественно 100 %-ное расходование кислоты и окислителя не может привести
даже к 50 %-ному количеству расходования указанного металла. Для первой точки
кривой (2) к расходованию 0,0643 молей Zn приводят начальные
загрузки кислоты и CuO 0,02 и 0,01 молей. Ясно, что должен быть
дополнительный кислый реагент для металла, к тому же присутствующий в реакционной
смеси в довольно больших количествах. Последним может быть вода, а одним из
путей её взаимодействия
Zn +
2H2O → Zn(OH)2
+ H2 (3)
Zn(OH)2 + HA → Zn(OH)A + H2O
(4)
и т.д.
В случае кривой (1)
рис.2 рост начальных загрузок CuO приводит к относительному
уменьшению содержания воды в системе, что может сказаться неблагоприятно на
скоростях взаимодействий металла с водой. Иными словами, в случае кривой (1)
рис.2 переменными являются три фактора, а именно начальные содержания оксида,
кислоты и воды. Причем, если первые два по величине растут, то последнее
падает.
В рассматриваемом
вопросе важное значение имеет и природа исходного соединения меди (II)
в качестве «окислителя» металла. Наивысшее значение скоростей наблюдалось,
когда CuA2 представлена нитратами и хлоридами (средними и
основными), а также хлоркупратом меди (II) Cu[CuCl4]. Наинизшие - при
переходе к карбоксилатам меди (II) в отсутствии
стимулирующих добавок.
Здесь следует
подчеркнуть, что ряды соединений Cu2+ по природе аниона для
солей и соединений в целом при переходе от одного металла-восстановителя к
другому разные, хотя хлориды во всех изученных
вариантах находятся в начале таких рядов. Особое место в них занимают
оксид, гидроксид и гидроксикарбонаты. Это практически нерастворимые в водных и
водноорганических средах соединения. При их использовании сначала должно произойти
взаимодействие этих соединений с кислотой. Для оксида, в частности, реализуется
схема [6]
CuО + HA → Cu(OH)A ![]() CuA2 + H2O
(3)
CuA2 + H2O
(3)
В случае гидроксида и основного карбоната такое
взаимодействие протекает сложнее. Как следствие системы с оксидом оказываются
более выигрышными в сравнении с системами с гидроксидом и основными карбонатами
и в рядах эффективности окислителей находятся далеко не на последних местах.
Совпадение анионов
используемых в загрузке кислоты и соли меди (II) необязательно, а в
целом, можно сказать, и нежелательно, поскольку при разных анионах в ряде случаев
имели место явления синергизма, причем весьма четко выраженного. Правда, не
исключены и явления антагонизма, хотя они встречаются гораздо реже.
Следует особо отметить и
роль минерализующих добавок в водных и водноорганических средах. Наиболее
изученными на данный момент времени являются хлориды щелочных металлов и
аммония, двух- и поливалентных металлов. По количеству таких добавок скорость
расходования металла часто растёт по типу кривой насыщения. Наиболее эффективными
из изученных на данный момент времени являются хлориды аммония, щелочноземельных
металлов и алюминия. Однако для разных металлов-восстановителей ряды эффективности
добавок также не совпадают, т.е. являются индивидуальными.
Нужно подчеркнуть и
важную роль исходного количества соединений меди (II) (пример кривая 2
рис.2). При малых количествах такого окислителя процесс можно рассматривать как
коррозионное поражение металла и оценивать пути замедления и ускорения данного
явления. А при средних и больших – это типичные технологические процессы, где
металлы, в том числе и отходы иных производств, могут рассматриваться в
качестве реагентов в способах получения целевой химической продукции.
1. С.Д. Пожидаева, А.М. Иванов, А.Ю. Елисеева, Д.А.
Сотникова. Циклическая макростадия в механизме низкотемпературного
гетерогенного гетерофазного окисления меди при её контакте с кислыми растворами
солей меди (II) // Veda a: krok do budoucnosti-2012: сб. матер. Междунар. науч.
– практ. конф. Прага, 2012. С. 45-48.
2. А.Ю. Елисеева, Д.А. Сотникова, С.Д. Пожидаева. Разрушение бронзовой детали под
воздействием подкисленных растворов хлорида меди (II) / Тезисы докладов VI Всероссийской конференции
молодых ученых, аспирантов и студентов с международным участием
«Менделеев-2012. Физическая химия». СПб.: Изд-во Соло, 2012.-634 с. С.291-293.
3. Д.А. Сотникова, А.Ю.
Елисеева, С.Д. Пожидаева, А.М. Иванов. Соли меди (II) как окислители
металлической меди при комнатной температуре и интенсивном механическом
перемешивании / Материалы Общероссийской с международным участием
научной конференции / Полифункциональные
химические материалы и технологии. Сборник статей. Томск: изд-во Томского гос.
ун-та, 2012. 375с. С.219-221
4. С.
Пожидаева, А.
Иванов. Жидкие фазы в реакциях металлов с
кислыми реагентами и окислителями. Deutschland/Германия: изд. LAP
LAMBERT Аcademic Publishing,
Saarbrücken. 2012.
353 с.
5. А.М. Иванов, С.Д.
Пожидаева. Использование бисерной мельницы для предотвращения и преодоления
самопрекращения окислительно-восстановительных и иных процессов с участием
оксидов переходных металлов и практические
решения на базе такого подхода / Курск: изд-во КурскГТУ, 2008. 328 с.
6. С.Д.
Пожидаева, А.М. Иванов, А.Ю. Елисеева, Д.А. Сотникова. Взаимодействие оксидов
металлов с кислотами в модельных условиях и в качестве промежуточной стадии
сложных окислительно-восстановительных процессов / Известия ЮЗГУ. Серия физика
и химия. Курск. 2011. №2. С. 38 – 45.