Биологические
науки / 2. Структурная ботаника и биохимия растений
Толкачева
Н.В.1, Ежов В.Н.1, Ольховская
В.А.2, Чирва В.Я.2, Комаровская-Порохнявец Е.З.3,
Новиков В.П.3
1 - Никитский
ботанический сад – Национальный научный центр НААНУ, отдел физиолого-биохимических исследований и
биотехнологии, 98648, Украина, АР Крым, г. Ялта,
пгт. Никита. E-mail: tolkacheva_n@mail.ru
2 - Таврический национальный университет им. В.И.
Вернадского, кафедра органической и биологической химии, 95007, Украина, АР
Крым, г. Симферополь, пр. Акад. Вернадского 4.
3 -
Национальный университет “Львовская политехника”, кафедра технологии
биологически активных соединений, фармации и биотехнологии, 79013, Украина, г. Львов, ул. С. Бандеры, 12.
Стероидные гликозиды соплодий Allium cyrillii (Alliaceae) и их биологическая активность
Стероидные гликозиды являются обширным
классом природных соединений из группы сапонинов, которые привлекают внимание
исследователей благодаря их широкому спектру биологической активности и
экологической безопасности [1-3]. Перспективными в плане поиска сапониноносных видов являются растения рода Allium, произрастающие в Крыму, тем более, что в литературе
данные о стероидных сапонинах большинства крымских луков отсутствуют. Именно поэтому изучение химической
структуры стероидных гликозидов представителей семейства Alliaceae является
актуальным.
Продолжая изучение стероидных гликозидов
лука Кирилла (увеличенного) Allium
cyrillii Ten. [4, 5], из соплодий выделен новый сапонин
спиростанолового ряда. После
кислотного гидролиза с помощью ТСХ путем
сравнения с заведомо известными образцами сахаров была идентифицирована только
глюкоза. Химические сдвиги всех протонов углеводного остатка были установлены с
помощью комбинации двумерных спектров TOCSY и COSY. 13C-Химические
сдвиги сигналов их соответствующих атомов однозначно отнесены с помощью
двумерного спектра HSQC. Структура гликозида установлена с помощью спектроскопии
ЯМР 13С (табл. 1) и 1Н. Сигналы в спектре ЯМР 13С
отнесены с помощью селективного двойного гетероядерного резонанса, а также
путем сопоставления с литературными данными [6-9].
Таблица 1
Химические сдвиги атомов углерода гликозида
|
С-атом |
Химический
сдвиг, м.д. |
С-атом |
Химический
сдвиг, м.д. |
|
1 |
48,1 |
18 |
16,6 |
|
2 |
73,2 |
19 |
17,6 |
|
3 |
77,4 |
20 |
42,2 |
|
4 |
35,0 |
21 |
14,9 |
|
5 |
48,5 |
22 |
111,6 |
|
6 |
70,4 |
23 |
40,9 |
|
7 |
40,9 |
24 |
81,5 |
|
8 |
30,0 |
25 |
38,2 |
|
9 |
54,8 |
26 |
65,1 |
|
10 |
37,7 |
27 |
13,5 |
|
11 |
21,5 |
|
|
|
12 |
40,2 |
Glc-1 |
106,5 |
|
13 |
40,9 |
2 |
75,7 |
|
14 |
56,3 |
3 |
78,7 |
|
15 |
32,1 |
4 |
71,7 |
|
16 |
81,6 |
5 |
78,1 |
|
17 |
62,9 |
6 |
62,9 |
Таким
образом, на основании химических и спектральных методов было установлено, что гликозид,
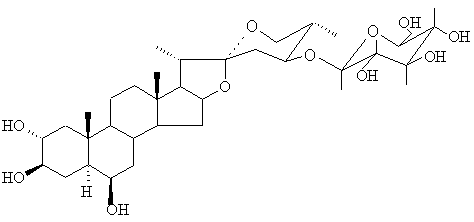
выделенный из соплодий Allium cyrillii, имеет структуру (24S,25S)-5α-спиростан-2α,3β,6β,24-тетраол-24-О-β-D-глюкопиранозида, ранее не описанную в литературе:
Следующим этапом исследований было изучение
бактерицидной, фунгицидной и рострегулирующей активности стероидных сапонинов соплодий
Allium cyrillii для
возможности их дальнейшего практического использования. В экспериментах использовались следующие
тестовые культуры: бактерии Escherichia
coli, Staphylococcus aureus, Mycobacterium luteum и грибы Candida
tenuis, Aspergillus niger.
Первичная
оценка антимикробной активности суммы стероидных гликозидов соплодий A. cyrillii проведена с помощью метода диффузии
в агар при концентрациях вещества 0,1;
0,5; 1,0 и 2,5%. Анализ полученных результатов свидетельствует о том, что в
исследуемых пределах концентраций зон угнетения роста микроорганизмов не
наблюдалось. Метод серийных разбавлений
веществ позволяет установить количественные показатели минимальной ингибирующей концентрации и минимальной биоцидной концентрации
относительно тестовых культур бактерий и грибов. В результате экспериментов
установлено, что тестовые культуры бактерий оказались нечувствительными к
действию суммы стероидных гликозидов в диапазоне концентраций 0,9–2000 мкг/см3.
В ходе изучения фунгицидных свойств суммы гликозидов
установлено, что в концентрации 31,2 мкг/см3
она обладает фунгистатическими свойствами относительно тестовой культуры плесневого гриба Aspergillus niger. Отсутствие роста гриба наблюдается при 2000 мкг/см3. Тестовая
культура Candida tenuis
оказалась резистентной к действию суммы сапонинов.
Результаты исследований, приведенные в
табл. 2, характеризуют сумму стероидных гликозидов как препарат с хорошо
выраженными рострегулирующими эффектами даже в
минимальной концентрации 1 мг/дм3. Так, в указанной концентрации
исследуемый образец стимулирует всхожесть кресс-салата на 14%. В концентрации 10
и 100 мг/дм3 наблюдается существенный стимулирующий эффект роста стебля кресс-салата на 20 и 25%,
соответственно.
Таблица 2
Количественные показатели рострегулирующей активности суммы
стероидных гликозидов соплодий Allium cyrillii
|
№ п/п |
Вещество |
Концентрация соединения,
мг/дм3 |
Линейные размеры частей кресс-салата и
всхожесть, % к контролю |
||
|
корень |
стебель |
всхожесть |
|||
|
1. |
Контроль |
Растворитель (ДМСО) |
100,0 |
100,0 |
100,0 |
|
2. |
Сумма СГ |
100 10 1 |
61,2 68,3 97,3 |
125,6 120,4 85,2 |
82,3 100,8 114,4 |
Кроме того, сумма стероидных гликозидов в
концентрации 10 и 100 мг/дм3 достаточно сильно ингибирует рост корня
кресс-салата (на 32 и 39%, соответственно), а также всхожесть на 18%
(концентрация суммы 100 мг/дм3). Ингибирующий эффект роста стебля кресс-салата установлен при действии суммы сапонинов в
концентрации 1 мг/дм3.
Литература:
1.
Кинтя П.К., Лазурьевский Г.В., Балашова Н.Н., Балашова
И.Т., Суружиу А.И., Лях В.А. Строение и биологическая активность стероидных
гликозидов ряда спиростана и фуростана. – Кишинев: Штиинца, 1987. – 142 с.
2.
Берсукер
И.Б., Димогло А.С., Чобан И.Н., Лазурьевский Г.В., Кинтя П.К. Корреляция между строением и противоопухолевой
активностью в ряду стероидных гликозидов // Хим.-фарм. журн. – 1983. – № 12. – С.
1467-1471.
3.
Васильева И.С., Удалова
Ж.В., Зиновьева С.В., Пасешниченко В.А. Стероидные фуростаноловые гликозиды –
новый класс природных адаптогенов // Прикладная биохимия и микробиология. – 2009.
– Т. 45, № 5. – С. 517-526.
4. Толкачева
Н.В., Шашков А.С., Чирва В.Я. Стероидные гликозиды луковиц Allium cyrillii (Alliaceae)
// Химия
природ. соедин. – 2012. – №2. – С. 243-246.
5.
Толкачева Н.В., Зайцев Г.П., Качала В.В., Гришковец В.И., Чирва В.Я.
Строение основного стероидного гликозида соцветий Allium cyrillii (Alliaceae). // Ученые записки ТНУ,
Серия «Биология, химия». – Т. 24(63). – 2011. – №2. – С. 390-395.
6. Mimaki Y, Kuroda M,
Fukasawa T, Sashida Y. Steroidal saponins from the bulbs of Allium
karataviense // Chem.
Pharm. Bull. – 1999.
– Vol. 47. – Р. 738-743.
7.
Воллернер Ю.С., Кравец С.Д., Шашков А.С., Горовиц М.Б., Абубакиров Н.К.
Строение анзурогенина С и анзурозида из соплодий Allium suvorovii и A. stipitatum. // Химия природ. соедин. – 1989. – №4. – С.
505-510.
8. Morita T.,
Ushiroguchi T., Hayashi N., Matsuura H., Itakura Y., Fuwa T. Steroidal saponins
from elefant garlic, bulbs of Allium
ampeloprasum L. // Chem.
Pharm. Bull. – 1988. – Vol. 36. – P. 3480-3486.
9.
Воллернер Ю.С., Абдуллаев Н.Д., Горовиц М.Б., Абубакиров Н.К. Строение
каратавигенина С. // Химия природ. соедин. – 1983. – №6. – С. 736-740.