Биологические науки/
Микробиология
К.б.н. Оспанкулова Г.Х., Каманова
С.Г., Тойымбаева Д.Б.
Казахский научно-исследовательский
институт переработки сельскохозяйственной продукции, Казахстан
E-mail: bulashevag@mail
Оптимизация процесса
биосинтеза целлюлаз и β-глюканаз
микробными продуцентами
Создание новых
штаммов, адаптированных к синтезу целлюлозолитических ферментов на средах с
труднодоступной целлюлозой, а также изучение ферментных комплексов, участвующих
в деградации труднометаболизируемых субстратов представляет особый интерес для
биотехнологии.
Источником многих
генетических вариаций штаммов-продуцентов является мутагенез, который позволяет
повысить производительность штаммов и снизить затраты на их культивирование.
Случайный мутагенез является удобным инструментом для достижения генетических и
функциональных изменений организма.
Для
усиления целлюлозолитической активности штаммов микроорганизмов была проведена
серия опытов по обработке комплексным поэтапным мутагенезом, включающим
химический мутагенез, УФ и рентгеновское облучение.
Объектом
настоящих исследований являлись штаммы микроскопических грибы рода Trichoderma/Hypocrea
SS7, DS4, Z8, выделенные из
различных субстратов.
Целлюлозолитическая
активность мутантных штаммов определялась на 7-е сутки культивирования по
методу, приведенному в [1] на средах с Na-КМЦ, МКЦ, FPA.
УФ-мутагенез
микроорганизмов проведен по методике Hamad A. и соавт. [2]. Химический
мутагенез проведен по методу Морикава и соавт.
[3]. Облучение проводили на установке АРг-Ц-РП (ПроГраф-7000Т)
производства ЗАО «Рентгенпром» (Россия). Для мутагенеза были использованы
семисуточные культуры микроскопических грибов на агаризованной среде Чапека. Облучение проводилось поэтапно: 1-я
доза - 3,6 микрозиверта, 2-я - 3,8 микрозиверта, темновая фаза 24ч. Споры
микроскопических грибов переносились на питательную среду с источником
целлюлозы. Через 24-48ч проводилось выделение моноспоровых культур мутантных
штаммов, и их инкубация в течение 7 суток при температуре 28оС.
Отобранные мутантные штаммы переносились с агаризованной питательной среды в
жидкую среду и культивировались в течение 7 суток при 28оС на
качалке при 220 об/мин. В отделенной от мицелия культуральной жидкости,
определялась активность КМЦ-азы по методу Шомоди-Нельсона [1] .
Исследование
влияния времени обработки УФ-облучения на целлюлозолитическую активность
штаммов микроскопических грибов Z8, SS7, DS4 проводилось при экспозиции от 10
до 180 мин без перерыва и дробно (через равные промежутки времени облучение
прерывалось на 5 мин), с последующей темновой фазой в течение 12 ч. Наибольший
выход активных мутантных штаммов отмечался при облучении УФ в течение 10 минут
штаммов Z8 – 2%, DS4 - 2,17%, а также
при дробном облучении в течение 120 мин: Z8 – 5,12%, DS4 - 4,85%, SS7 – 1%.
Последующие ступени мутагенеза оказались неэффективными, активность мутантных
штаммов снижалась, не было получено ни одного мутанта с высокой
целлюлозолитической активностью.
Была
выявлена прямая корреляционная зависимость выхода активных мутантных штаммов от
ступени УФ-мутагенеза. В сравнении с исходным штаммом, Z8 мутантные штаммы всех
ступеней обладали высокой целлюлозолитической активностью на таких субстратах,
как NaКМЦ, FPA. Зона деструкции этих субстратов достигала 12мм. Аналогичные
результаты были получены при использовании других штаммов рабочей коллекции
(рисунок 1).
УФ-облучение
(экспозиция 10 мин, 5 мин перерыв, 12ч – темновая фаза)
А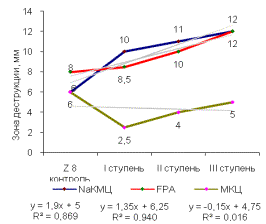 Б
Б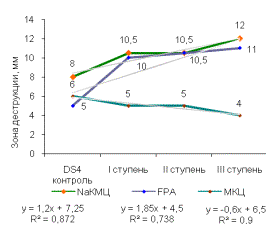
УФ-облучение (экспозиция 120
мин, 5 мин перерыв, 12ч – темновая фаза)
В
 Г
Г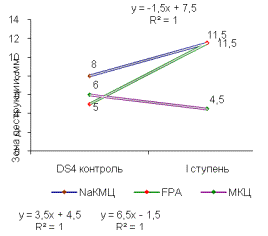
Д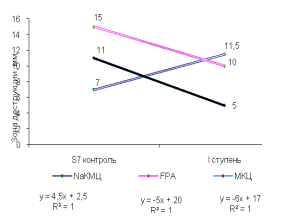
Рисунок 1 -
Целлюлозолитическая активность штаммов:
(А, В) - Z8, (Б, Г) - DS4, (Д)
- SS7
На
основании результатов исследования было установлено, что для микроскопических
грибов оптимальным является использование многоступенчатого дробного мутагенеза
(не более 3-х ступеней), времени экспозиции 10мин и 120мин с интервалом 5 мин,
обязательно наличие темновой фазы в течение 12 часов после завершения
облучения.
Одним
из методов проведения мутагенеза микроорганизмов, с целью изменения
ферментативных свойств, является использование химических веществ, таких, как
нитрозометилмочевина.
С
целью усиления целлюлозолитической активности микроскопических грибов был
проведен многоступенчатый химический мутагенез штаммов. Выявлено, что
оптимальным является проведение 3-х ступенчатого химического мутагенеза грибов.
Четвертая и последующая ступени обработки отобранных штаммов
нитрозометилмочевиной в концентрации 0,005% снизили жизнеспособность спор и
целлюлозолитическую активность полученных моноспоровых мутантов.
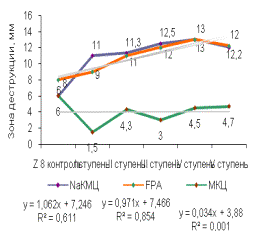
Была
выявлена прямая корреляционная зависимость выхода активных мутантных штаммов от
ступени химического мутагенеза (рисунок 2). Зона деструкции этих субстратов
достигала 14мм.
Первая
ступень химического мутагенеза позволяет получить мутантные штаммы с высокой
целлюлозолитической активностью по отношению к FPA и МКЦ, зона деструкции
составляет в среднем от 11 до 12,5 мм, а на NaКМЦ активность остается
неизменной. После 3 ступени мутации целлюлозолитическая активность мутантных
штаммов падает на всех субстратах. Наибольшей целлюлозолитической активностью
обладал мутантный штамм DS4/2(0,015)/10(0,005)/2(0,005).
А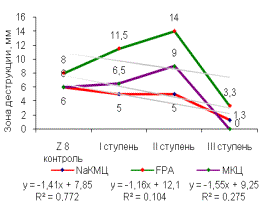 Б
Б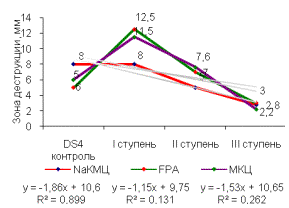
В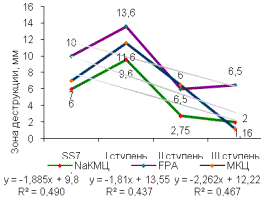
Рисунок 2 –Целлюлозолитическая
активность штамма, многоступенчатый химический мутагенез (А) - Z8, (Б) - DS4,
(В) - SS7
Было
отобрано 8 мутантных штаммов с высокой целлюлозолитической активностью,
полученные после 2-ой ступени химического мутагенеза. Штаммы обрабатывались
УФ-облучением в течение 10 минут, с перерывом 5 мин и темновой фазой 12 ч.
Максимальный выход мутантов с высокой целлюлозолитической активностью по
отношению к FPA был отмечен у штаммов SS7/14(0,01)/1(0,005),
DS4/2(0,005)/4(0,005) и составил 14,3%-11,8%, зона деструкции достигала 30мм.
Среди мутантных штаммов, активно разрушающих МКЦ, выход достигал 7,7%, 5,9%,
4,5% по исходным штаммам SS7/12(0,015)/4(0,005), DS4/2(0,005)/4(0,005),
SS7/12(0,005)/4(0,005) соответственно. Были отобраны мутанты:
DS4/21(0,015)/3(0,005)/27(УФ); SS7/12(0,015)/4(0,005)/1(УФ).
Рентгеновскому
облучению подвергались штаммы рабочей коллекции: штамм прошедший 4-ступени УФ
облучения (Z8/4-9-68-12), после 1-ой ступени химического мутагенеза НММ в
концентрации 0,05% Z8/25(0,015)), штаммы после 2-х ступеней химического
мутагенеза и 1-ой ступени УФ-облучения DS4/21(0,015)/3(0,005)/27(УФ),
SS7/12(0,015)/4(0,005)/1(УФ).
При
облучении рентгеном мутантного штамма Z8/25(0,015), полученного в результате
одной обработки нитрозометилмочевиной в концентрации 0,005%, были получены
культуры, которые проявили среднюю целлюлозолитическую активность, когда зона
деструкции составляла 5-10мм, по всем источникам целлюлозы. У штамма
DS4/21(0,015) целлюлозолитическая активность была очень низкой, зона деструкции
не превышала 2 мм по таким источникам целлюлозы, как NaКМЦ и МКЦ.
Рентгеновское
облучение не дало положительного результата и при обработке мутантного штамма
Z8/4-9-68-12, который предварительно был получен на 4-й ступени УФ облучения,
зона деструкции NaКМЦ не превышала 3мм.
В
результате рентгеновского облучения у мутантных штаммов, полученных в
результате двух ступеней обработки нитрозометилмочевиной и одной ступени УФ
облучения, было отмечено усиление целлюлозолитической активности (зона
деструкции NaКМЦ - до 25мм). К примеру,
мутантный штамм SS7/12(0,015)/4(0,005)/1(УФ) проявил высокую
целлюлозолитическую активность, зона деструкции NaКМЦ составляла – 25 мм, FPA -13 мм, МКЦ – 10 мм.
Следовательно,
наиболее эффективным для получения мутантных штаммов с высокой
целлюлозолитической активностью является проведение комплексного поэтапного
воздействия: химического мутагенеза с концентрацией нитрозометилмочевины 0,005
и 0,015%, 10 минутного УФ-облучения с перерывом пять минут и темновой фазой 12ч
и дробного рентгеновского облучения дозой 3,6 и 3,8 микрозиверта. В результате многоступенчатого
мутагенеза получен высокоактивный мутантный штамм Trichoderma harzianum SS7/12(0,015)/4(0,005)/1(УФ)-Р, который будет
исследован в целях получения ферментов.
Литература:
1
Синицин А.П., Черноглазов В.М., Гусаков А.В. Методы определения активности
целлюлаз. Итоги науки и техники. Биотехнология. 1993, Т.25.с.38-64.
2 Hamad A, Haq I, Qadeer MA,
Javed I (2001). Screening of Bacillus licheniformis mutants for improved
production of alpha-amylase. Pak. Jour. Bot. 33 (special issue): 517-525.
3 Morikawa Y, Kawamori M, Ado
I, Shinsha I, Oda F, Takasawasa S, (1985). Improvement of cellulase production
in Trichoderma reesei. Agric. Bio.
Chem. 49: 1869.