Химия и химические технологии/8.
Кинетика и катализ
К.х.н. Корчагин
О.В.
Федеральное
государственное бюджетное учреждение науки Институт
физической химии и электрохимии имени А. Н. Фрумкина РАН, Москва, Россия
Электрокатализ
прямого окисления бутанола в щелочной среде
В последние годы наблюдается постоянный рост количества работ,
посвященных низкотемпературным топливным элементам (ТЭ). Одну из ведущих
позиций занимают исследования по созданию ТЭ с прямым окислением алифатических
спиртов. Эти электрогенераторы объединяют преимущества водородо-воздушного ТЭ с
возможностью применения жидкого топлива, которое отличается безопасностью
хранения и высокой объёмной плотностью энергии. Основной задачей реализации
спиртового ТЭ является разработка активного и стабильного анодного
катализатора. Поскольку энергоемкость возрастает при увеличении длины углеводородной цепи
спирта, особый интерес представляют исследования, посвященные вопросам
электроокисления спиртов, содержащих два и более атома углерода в молекуле. Однако,
если по электрокатализу процесса окисления этанола получены весьма обширные
данные [1], можно отметить лишь единичные исследования, посвященные
электроокислению бутанола [2]. Установлено, что процесс протекает с заметной
скоростью в щелочной среде на золоте и металлах платиновой группы. При этом
отсутствуют работы, направленные на создание катализаторов с высокой массовой
активностью, пригодных для использования в составе ТЭ окисления бутанола.
Универсальным способом создания катализаторов
для ТЭ является формирование наночастиц активных металлов на поверхности
высокодисперсных углеродных носителей. Настоящая работа посвящена исследованию окисления бутанола на наноразмерных
системах: на коммерческих катализаторах 20%Pt/C (указано содержание металла в
системе катализатор/носитель) и 20%Pd/C, а также на 20% Ru/C и
20%Au/C-катализаторах, синтезированных по оригинальным методикам на саже ХС-72 [3, 4]. Средние размеры
наночастиц металлов в системах 20% Ru/C и 20%Au/C по данным просвечивающей
электронной микроскопии составляли 5.9 и 5.5 нм, соответственно. Электрохимические
исследования проводили в стандартной трехэлектродной ячейке. Рабочий электрод
формировали путем нанесения смеси катализатора и связующего Nafion на никелевую
сетку в количестве 0.1 мг (катализатора)/см2.
На рис.
представлены квазистационарные поляризационные кривые, измеренные на исследуемых катализаторах в щелочном растворе
бутанола. 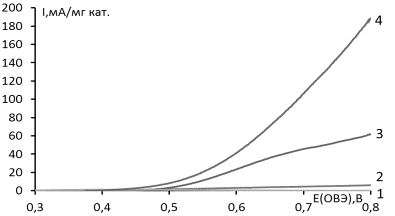
Рис. Квазистационарные
поляризационные кривые, характеризующие окисление бутанола-1 на
монометаллических катализаторах: 1 – Ru/С, 2 – Pt/С, 3 – Pd/С, 4 – Au/С. 1 М КОН + 0.5 М C4H9OH. Скорость развертки
1 мВ/с, t=60 oC.
Как видно, исследуемые
катализаторы образуют следующий ряд в порядке возрастания активности: Ru/C<Pt/C<Pd/C<Au/C.
Катализатор на основе золота характеризуется наименьшими величинами энергии
активации и поляризационного сопротивления среди рассмотренных систем (табл.
1). При этом величина квазистацинарного потенциала, устанавливающегося на
золоте, выше по сравнению с данными для платины и рутения.
Таблица 1.
Характеристики процесса окисления бутанола на монокомпонентных катализаторах.
|
Катализатор |
i (при 0,5 В, 60oС), мА/мгкат. |
i (при 0,8 В, 60oС), мА/мгкат |
(2 наклона) |
Еа, кДж/моль |
|
20% Pt |
1.96 |
5.34 |
0.0977 0.6416 |
45.57 |
|
20% Pd |
1.47 |
38.25 |
0.0491 0.4063 |
59.31 |
|
20% Ru |
0.89 |
0.04 |
0.0767 |
55.07 |
|
20% Au |
8.52 |
184.09 |
0.0419 0.2183 |
40.97 |
Таблица 2. Результаты исследования катализаторов
на стабильность. Eст
– квазистационарный потенциал. i (0,6 В) – величина удельного тока при
потенциале 0,6 В на анодном ходе развертки квазистационарной кривой.
|
Катализатор |
Eст , В до (после) транзиента тока |
i (0,6 В), мА/мг кат. до (после) транзиента тока |
iпосле/iдо |
|
20% Pt |
0.30 (0.48) |
4.4 (1.2) |
0.28 |
|
20% Pd |
0.47 (0.56) |
10.7 (0.7) |
0.07 |
|
20% Au |
0.39 (0.41) |
41.3 (24.6) |
0.60 |
|
20% Pd1-Au4 |
0.35 (0.42) |
41.2 (10.9) |
0.26 |
|
40% Pt |
0.31 (0.47) |
5.4 (1.2) |
0.23 |
|
40% Pt-Ru |
0.20 (0.32) |
18.3 (6.3) |
0.34 |
|
40% Pt3-Sn1 |
0.28 (0.42) |
6.4 (1.9) |
0.31 |
|
20% Ru-Ni |
0.21 (0.40) |
1.5 (0.3) |
0.20 |
Проведены
испытания катализаторов на стабильность путем выдержки при поляризации 0.2 В в
течение 30 мин с измерением квазистационарных кривых до и после испытаний (табл. 2). Можно отметить, что в случае
Au/C наблюдается менее выраженная дезактивация процесса по сравнению с
характеристиками других электродов.
Полученные
результаты существенно отличаются от имеющихся
данных по электрокатализу окисления метанола и этанола на золоте и платиновых
металлах. Известно, что на золоте, в
отличие от платины, практически не
происходит дегидрирования и хемосорбции органических частиц [5]. Реакции окисления спиртов протекают с
заметной скоростью только в щелочи и обусловлены предшествующей химической
стадией образования алкоксидов. Алкоксиды обладают выраженными нуклеофильными
свойствами, что определяет их высокую реакционную способность. Основными
продуктами их окисления на золоте являются соответствующие альдегид и кислота.
Показательно, что при поляризации золотого электрода в растворе бутанола
происходит менее выраженная дезактивация,
чем в случае платины, палладия и даже бинарной системы PtRu. Этот эффект, а
также повышенное начальное значение
квазистацинарного потенциала (табл. 2),
указывают на меньшую роль хемосорбции при окислении спирта на золоте по
сравнению с другими электродами. Можно предположить, что снижение общей
скорости процесса при переходе от золота к платине обусловлено тем, что на
платине окисление бутанола идет скорее через образование прочно адсорбированных
частиц, чем алкоксидов, причем эффект отравления поверхности выражен сильнее, чем
в случае спиртов с более короткой углеводородной цепью.
С
точки зрения практического использования
результатов работы можно отметить, что скорость окисления бутанола на Au/C соответствует характеристикам, достигаемым при окислении этанола на катализаторах типа Ru-M [3], что создает хорошие предпосылки для
реализации ТЭ прямого окисления бутанола.
Литература:
1.
Antolini E., Gonzalez E.R.// J.
Power Sources. 2010. V. 195. P. 3431.
2.
Takky D., Beden B., Leger J.M. and Lamy C. // J. Electroanal. Chem. 1983. V. 145. P. 461.
3.
Корчагин О.В.,
Тарасевич М.Р., Давыдова Е.С., Модестов А.Д., Новиков В.Т. // Альтернативная энергетика и экология.
2011. № 10. С. 117.
4.
Трипачев О.В., Корчагин О.В., Тарасевич
М.Р. // Альтернативная энергетика и экология. 2012. №
2. С. 146.
5. Lai
S.C.S., Kleijn S.E.F., Öztürk F.T.Z., Rees Vellinga Koning V.C. J.,
Rodriguez P., Koper M.T.M. // Catalysis
Today. 2010. V. 154. P. 92.