Оналбаева Ж.С.
Восточно-Казахстанский
государственный технический университет
им. Д. Серикбаева, г.
Усть-Каменогорск, Казахстан
Современное состояние сульфатной
технологии производства гидроксида бериллия из минерального сырья
Сульфатный способ извлечения бериллия основан на
том, что при обработке берилла серной кислотой образуются растворимые в воде
сульфаты бериллия и алюминия и нерастворимый оксид кремния. Берилл взаимодействует
с серной кислотой очень медленно, но при определенных условиях можно добиться
заметного ускорения реакции. Так, взаимодействие берилла с концентрированной
серной кислотой при температуре 400 °С в автоклаве позволяет перевести за
несколько часов в водорастворимую форму до 50÷60 % бериллия. Реакция
ускоряется в присутствии фторидов благодаря воздействию фтористого водорода.
Так как скорость реакции в этом случае всё же остается малой и, кроме того, при
этом возникают трудности, сопряжённые с коррозией аппаратуры, этот способ
вскрытия промышленного применения не нашёл. Для всех промышленных сульфатных
процессов с целью повышения его активности берилл приходится подвергать его
предварительной обработке, пользуясь термической обработкой, которая изменяет
его кристаллическое строение. Технологическая схема переработки концентрата по
сульфатному способу приведена на рисунке 1.
В процессе термической обработки берилл плавят и
затем охлаждают в воде. Если закалку провести достаточно быстро, то
кристаллическое строение берилла изменяется, что значительно упрощает его
вскрытие серной кислотой. Однако при этом с серной кислотой взаимодействует
всего 50÷60 % бериллия, поскольку нерастворимый остаток представляет
собою твердый раствор оксида бериллия в кремнеземе, не поддающийся вскрытию
серной кислотой. При последующем нагреве такого берилла при 900 °С из твердого
раствора выпадает оксид бериллия, при взаимодействии которого с серной кислотой
до 90–95 % бериллия превращается в сульфат. После сплавления берилл уже
растворяется в серной кислоте. Термически обработанный берилл реагирует только с
горячей концентрированной кислотой при
нормальном давлении [1-11].
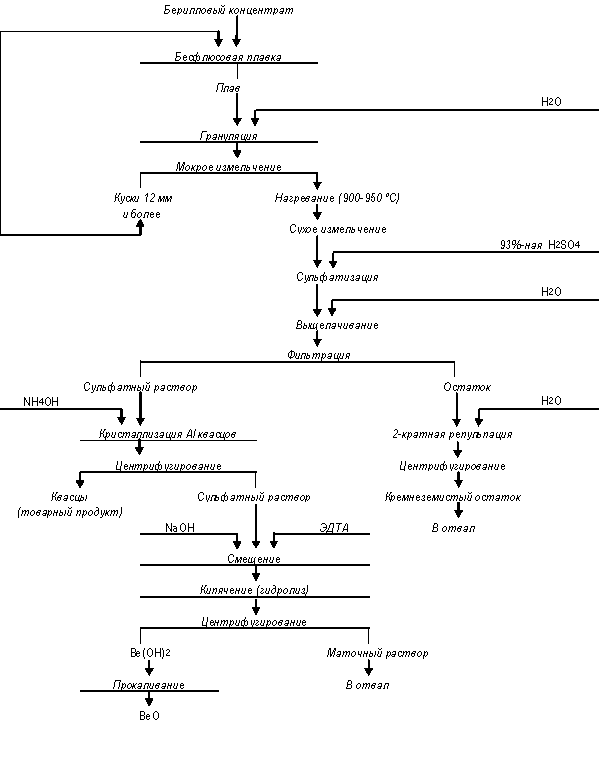
Рисунок 1 –
Технологическая схема переработки бериллового концентрата по сульфатному
способу
Сульфатный раствор от выщелачивания содержит, г/дм3:
35,1 ВеО, 40,0 Al2O3, 3,0 Fe2O3, 0,2 SiO2 [10].
Раствор сульфатов обычно содержит большое
количество сульфатов алюминия и заметное количество сульфатов железа, поскольку
алюминий всегда входит в состав берилла, а железо всегда присутствует в нём.
Кроме того в растворе всегда содержатся и другие примеси в небольшом
количестве. Для очистки этого раствора предлагалось много методов. Обычно
большую часть алюминия удаляют в виде алюмоаммонийных или алюмокалиевых
квасцов, образующихся при добавлении избытка сульфата аммония или калия к
горячему раствору. При охлаждении выпадают кристаллы квасцов, которые отделяют
фильтрованием [3]. В данном способе переработки сульфатного раствора гидроксида
бериллия осаждается с помощью гидролиза, не прибегая к специальным способам
удаления примесей из раствора. К сульфатному раствору после отделения квасцов
добавляют комплексообразователь трилон Б (ЭДТА – этилендиаминтетрауксусная кислота);
при этом примеси железа, марганца, кальция и магния связываются в комплексы и
остаются в растворе.
Для осуществления гидролиза раствор после
отделения квасцов непрерывно перекачивают через дозирующий счётчик в реактор
из нержавеющей стали. Туда же вливают необходимое количество разбавленного
раствора едкого натра и трилона Б. Образовавшийся раствор бериллата и алюмината
натрия непрерывно поступает в гидролизатор, где доводится до кипения. При этом
в осадок выпадает кристаллический β-гидроксид бериллия. Алюминат натрия в
данных условиях гидролиза (высокая температура, большой избыток щелочи) не
гидролизуется и остается в щелочном маточном растворе.
Гидроксид бериллия отделяют от маточника на
центрифуге. Извлечение бериллия на этой операции составляет 97 %.
Положительной стороной сульфатного способа
является простота технологии – все химические операции проводятся непрерывно и
полностью автоматизированы. Очень удачно решены вопросы, связанные с
разложением концентратов без флюсов и очисткой растворов от примесей. Применением
комплексообразователя предельно упростились переделы, связанные с очисткой от
примесей.
Недостатком процесса является большой расход
щелочи, которую невозможно регенерировать, так как в результате гидролиза
щелочной маточник содержит значительное количество сульфата натрия,
образованного на стадии нейтрализации [10].
Литература:
1. Силина Г.Ф., Зарембо
Ю.И., Бертина Л.Э. Бериллий, химическая технология и металлургия. – М.:
Атомиздат, 1960. – 120 c.
2. Уайт Д., Берк Дж.
Бериллий. – М.: ИЛ, 1960. – 616 c.
3. Дарвин Дж., Баддери
Дж. Бериллий. – М.: ИЛ, 1962. – 324 c.
4. Химия и технология редких и рассеянных элементов: В
2 т. / Под ред. К.А. Большакова.
– Т. 2: Технология редких и рассеянных элементов. – М.: Высшая школа, 1969. –
640 c.
5. Хлебникова Е.Н. Определение физико-химических характеристик минералов бериллия и лития, и
выбор оптимальных условий их вскрытия в гидрометаллургии: Дис. … магистра техн. наук. Усть-Каменогорск, 2013. – 87 с.
6. Зеликман А.Н.,
Меерсон Г.А. Металлургия редких металлов. – М.: Металлургия, 1973. – 608 c.
7. Зеликман А.Н.,
Коршунов Б.Г. Металлургия редких металлов. – М.: Металлургия, 1991. – 432 с.
8. Самойлов В.И. Экспериментальная разработка перспективных
химических методов извлечения бериллия и лития из минерального сырья. –
Усть-Каменогорск: Медиа-Альянс, 2006. – 551 с.
9. Самойлов В.И., Борсук А.Н. Методы совместной переработки
фенакита, бертрандита и берилла в гидрометаллургии бериллия. –
Усть-Каменогорск: Медиа-Альянс, 2006. – 200 с.
10. Коленкова М.А., Крейн О.Е.
Металлургия рассеяных и легких редких металлов. – М.: Металлургия, 1977. – 360
с.
11. Химическая технология и
металлургия бериллия и его сплавов: Сб. переводов / Под ред. М.Б. Борисова. –
М.: ИЛ, 1953. – Ч. I. – С. 5-25.