Dr.Sci.Biol. Yeroshenko F.V.
Stavropol research Institute of agriculture
STRUCTURAL ORGANIZATION OF
PHOTOSYNTHETIC APPARATUS IN WINTER WHEAT PLANTS OF TALL AND LOW-GROWING
VARIETIES
Первичные
процессы фотосинтеза проходят с участием структурно организованной системы
фотосинтетического аппарата, которая способна поглощать, концентрировать и преобразовывать
световую энергию в энергию стабильных связей химических соединений (АТФ и НАДФН+)
[1]. Поэтому активность и эффективность фотохимических стадий зависит как от
количества, так и от размеров компонентов фотосинтетического аппарата.
Превращение
световой энергии в химическую происходит с использованием двух функционально
сопряженных фотосистем, которые имеют фотоактивные реакционные центры (РЦ), а
также первичные доноры и акцепторы электронов. Реакционные центры фотосистем
окружены пигментами светособирающего комплекса, размеры которого определяются
генотипом и условиями, в которых произрастает растение. На каждый реакционный
центр приходится в среднем по 400-500 молекул хлорофилла, примерно половина
которого принадлежит светособирающему комплексу. Другая часть хлорофилла
относится непосредственно к фотосистеме I и фотосистеме II, образуя
фокусирующую антенну.
Для
изучения первичных процессов фотосинтеза широко применяется метод замедленной
флуоресценции (ЗФ) [2]. С помощью этого метода можно оценить количество
реакционных центров и размеры светособирающей системы анализируя образцы,
обработанные диуроном (DCMU) [3, 4].
Объекты
исследований ‒ растения озимой пшеницы разливных сортов: высокорослых
‒ Дея, Безостая 1, Русса, Уманка, Дельта, Зимородок и Дон 93; низкорослых
– Ермак, Фишт, Дон 95, Прикумская 140, Станичная, Краснодарская 99 и Донская
юбилейная. Отбор образцов и лабораторные анализы проводили в период налива
зерна (флаг-лист).
Наши
исследования показали, что величина выхода послесвечения, выдержанных в диуроне
образцов у низкорослых сортов озимой пшеницы выше, чем у высокорослых (рис. 1).
Интенсивность ЗФ в этих условиях пропорциональна скорости рекомбинации первично
разделенных зарядов в реакционных центрах фотосистемы II, и, следовательно, интенсивность свечения в этом
случае зависит только от абсолютной концентрации реакционных центров.
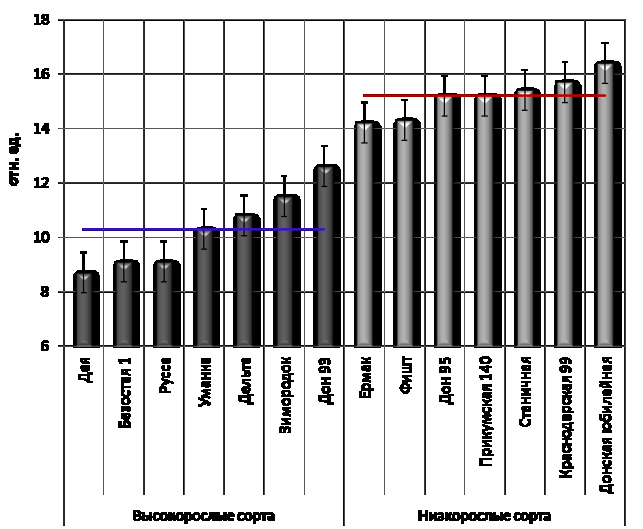
Рисунок 1 –
Интенсивность ЗФ листьев, обработанных диуроном (прямые линии – среднее).
Следовательно,
в наших опытах низкорослые сорта имели большее количество реакционных центров
фотосистемы II, чем высокорослые (в среднем на
32,2%). Но, так как соотношение реакционных центров фотосистемы II и фотосистемы I находится в прямой зависимости, можно сделать вывод о
том, что низкорослые сорта по общему количеству реакционных центров превосходят
высокорослые.
Размеры
светособирающей антенны фотосинтетической единицы можно определить в
относительных единицах с помощью световой кривой ЗФ образцов, обработанных
диуроном ‒ полунасыщающая интенсивность возбуждающего света обратно
пропорциональна относительному размеру фотосинтетической единицы (рис. 2).
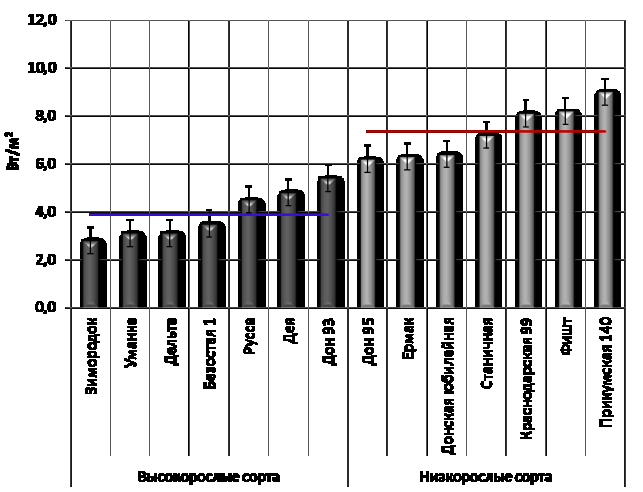
Рисунок
2 – Полунасыщающая интенсивность
возбуждающего света замедленной флуоресценции образцов, обработанных диуроном
(прямые линии – среднее).
Анализ
полученных значений этого показателя позволяет сделать вывод о там, что
низкорослые формы озимой пшеницы характеризуются меньшими размерами
светособирающего комплекса фотосинтетической единицы, чем высокорослые.
Следовательно,
структурная организация первичных процессов фотосинтеза растений низкорослых
высокопродуктивных сортов озимой пшеницы характеризуются большим количеством
реакционных центров, но меньшими размерами светособирающего комплекса, чем
менее продуктивных высокорослых. Полученные нами результаты согласуются с
литературными данными о том, что если при изменении гена, ответственного за
размеры светособирающего комплекса, получить формы водорослей с уменьшенной
антенной, то их продуктивность резко возрастает [5].
Литература:
1. Rubin A.B. R
egulation of primary photosynthetic processes / A.B.Rubin, T.E.Krendeleva //
Biophysics. ‒ 2004. ‒ Т. 49. ‒ № 2. ‒ С. 223-237.
2. Stirbet A.
Modeling chlorophyll a fluorescence transient: relation to photosynthesis /
A.Stirbet, G.Yu.Riznichenko, A.B.Rubin, Govindjee // Biochemistry (Moscow). ‒ 2014. ‒ Т. 79. ‒ № 4. ‒
С. 291-323.
3. Маторин Д.Н. Замедленная флуоресценция и
ее использование для оценки состояния растительного организма / Д.Н.Маторин,
П.С.Венедиктов, А.Б.Рубин // Извест. АН СССР : сер. Биологическая. – 1985. –
№4. – С. 508-520.
4. Венедиктов П.С. Первичные процессы
фотосинтеза и физиологическое состояние растительного организма /
П.С.Венедиктов, Т.Е.Кренделева, А.Б.Рубин. - М.: Наука, 1982. – 55 с.
5. Melis A.
Suppression of Tla1 gene expression for improved solar conversion efficiency
and photosynthetic productivity in plants and algae / A.Melis, M.Mitra. –
United States Patent № 7745696. – 2010.