к.х.н. Алиева С.К., к.х.н. Магомедова М.М.
ФГБОУ «Дагестанский государственный университет»
г. Махачкала
Взаимное
влиянии бензольного кольца и присоединенных групп в исследовании производных
бензальдегида
В последние два-три
десятилетия был получен большой экспериментальный материал, который потребовал
дальнейшего развития теории химического строения. Основная масса новых факторов
относится к проблеме взаимного влияния атомов в молекулах. Важнейшие из этих
факторов связаны с взаимным влиянием не связанных атомов, передачей взаимного
влияния вследствие пространственных препятствий, а также с устойчивостью
некоторых свободных радикалов, цветностью органических соединений и с другими
явлениями. На основании большого опытного материала и его трактовки с точки
зрения современных представлений о строении атома и природе химической связи
оказалось возможным разработать некоторые общие положения о взаимном влиянии
атомов. Огромное значение имеет широко исследованное явление взаимного влияния
атомов, непосредственно связанных друг с другом.
Целью данного исследование
является изучение строение производных сложных эфиров п-нитробензойной кислоты
методом дипольных моментов ИК-спектроскопии.
Рассматриваемые объекты
интересны тем, что в зависимости от природы заместителя в сложно-эфирной группе
пространственная структура этих соединений различна. Кроме того, изучаемые
соединения интересны с точки зрения использования их в качестве лигандов в
реакциях комплексобразования.
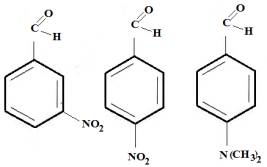
В качестве объектов исследования нами были
использованы следующие соединения:
Основным методом,
использованным в исследовании явился метод дипольных моментов [1,2].
Измерение статистической
диэлектрической проницаемости εисследуемых
растворов проводилось на приборе «измеритель емкости цифровой Е 8-4» при
температуре 25°С.
В качестве растворителя
был выбран четыреххлористый углерод, так как все исследуемые нами вещества хорошо
в нем растворялись.
Плотности растворов
определялись в пикнометре, проградуированному по бидистиляту при температуре
25° С ± 0,1 °С.
Сам эксперимент сводился
к измерению диэлектрической проницаемости и плотности четырех разбавленных
растворов исследуемого соединения, в интервале концентраций растворенного
вещества от 0,1 до 0.04 мольных долей. При расчете дипольных моментов
использовался метод Гедестранда. По данному методу экстраполяцией к нулевой
концентрация диэлектрической проницаемости ε и плотности d, которые являются линейными функциями концентраций, в
мольных долях X растворенного, получают ![]() и
и ![]()
Для точности расчет
результатов проводили на компьютере Acer с
процессором Pentium 4, на программе,
составленной на языке Delfi, по методу
наименьших квадратов.
Исследование
большинства структурных проблем, проводимое с помощью данных о дипольных
моментах молекул, основывается на сопоставлении экспериментальных величин
дипольных моментов с величинами, рассчитанными по аддитивной схеме [2].
Дипольные моменты
связей и групп, в свою очередь, находят или путем теоретической оценки из
квантово - химических расчетов, или полуэкспериментальными методами из
интенсивностей колебательных полос поглощения, либо путем векторного сложения
дипольного момента некоторых симметричных молекул.
Основой системы
дипольных моментов связей является величина момента связи С-Н метильной группы,
которая, по рассчитанным и экспериментальным данным, в том числе и по данным
ИК-спектров была принята за величину, близкую к 0,4D. Вместе с тем, всегда следует учитывать гибридное
состояние атома углерода, при котором находится протон. По данным ИК-измерений
были установлены следующие значения моментов связей: Сsp3 - Н+ =
0,31 D; Csp2 - Н+ =
0,63 D; Csp-H+ = 1.05D. Соответственно будут меняться моменты связей С - С с
различными гибридными состояниями атома углерода и дипольные моменты молекул в
целом. Во многих случаях удобнее пользоваться не моментами связей, а моментами
отдельных групп. Например, при анализе дипольного момента ароматических
нитросоединсний нет необходимости учитывать отдельные моменты связей C-N, N=0, N-О, а целесообразно ввести результирующую величину
группового момента NO2. При этом NO2 принимается равным дипольному моменту бензола и,
следовательно, является фактически суммой моментов нитрогруппы и С - Н-связи в
п-положении. Это очень удобно, т. к. позволяет исключить введение в расчеты в
явном виде моментов связей С - Н. Действительно, дипольный момент
м-нитробензола, например, можно рассчитать просто как векторную сумму двух
моментов NO2.
Ароматические альдегиды
содержат альдегидную группу, связанную с ароматическим ядром, и являются
исходными продуктами для синтеза трифенилметановых красителей и вкусовых
веществ.
Для изучения строения
молекул производных бензальдегидов нами были определенны дипольные моменты.
Решение вопроса о
структуре этих соединений, основывалось на сопоставлении экспериментальных и
вычисленных значений дипольных моментов.
Как известно, передача
полярного воздействия заместителей на другие атомы в молекулах может
происходить как последовательно через связи, соединяющие атомы, так и
непосредственно, вследствие наличия вокруг полярной группы электрического поля.
Внутреннее электрическое поле молекул неоднородно и электроны распределяются
неравномерно, ввиду различной электроотрицательности атомов. Поэтому
органическая молекула обычно оказывается поляризованной.
В исследуемых объектах
взаимное влияние атомов и групп обусловлено взаимодействием их неподдельных
электронных пар или связей с л - электронным облаком
остальной части молекулы: в результате чего возникает общее π -электронное
облако, охватывающее большой участок .молекулы, т.е. вызывает эффект сопряжения
(С-эффект).
Как отмечалось ранее,
все электронные смещения, происходящие в органических соединениях, проявляются
в величине дипольного момента [3].
Само бензольное кольцо
имеет дипольный момент равный 0,4Д.
Введение альдегидной
группы, которая является электроноакцептором, увеличивает величину дипольного
момента 2,98 Д.
Нитрогруппа, являясь
достаточно полярной, введенная так же в бензольное кольцо повышает его значение
до 3,96 Д.
Одновременное введение
двух акцепторов в пара- положение бензольного кольца приводит к величине
дипольного момента в 3,2Д, т.е. среднее между нитропроизводным и альдегидом.
Для данной молекулы,
вычисленное значение дипольного момента ниже, чем у экспериментального.
Известно, что векторные
расчеты дипольных моментов не могут учитывать все электроотрицательные
взаимодействия, происходящие в молекуле [4].
При введении NO2 группы в
мето- положение от альдегидной группы дипольный момент уменьшается и равен 2,42
Д [5].
В данной молекуле
возможны две плоские конфигурации цис- и транс-формы
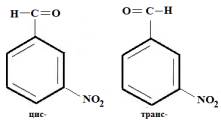
Из двух возможных
конфигураций нитробензальдегида преобладает S-транс- форма, в которой нитрогруппы и карбонильный
кислород, несущие отрицательные заряды, расположены на большем расстоянии чем в
цис-форме.
Вычисленный дипольный
момент 3,601Д не совпадает с экспериментальной величиной и отвечает значению,
рассчитанному для цис-формы. Это является свидетельством того, что данная
молекула существует в форме транс- или находится в угловой изомерии. В таблице
1 приведены экспериментальные значения дипольных моментов и векторно рассчитанные
при 25°С.
Таблица
1.
Экспериментальные значения дипольных моментов
производных бензальдегида и векторно рассчитанные при 25°С
|
Соединения |
|
|
|
м - C7H5NO3 |
2,42 |
3,601 |
|
п -C7H5NO3 |
2,43 |
1,05 |
|
п-С9Н11 NO |
2,27 |
4,54 |
В
случае п - нитробензальдегида можно рассчитать величину взаимодействия.
![]() выч =
выч = ![]() эксп +
эксп +![]() выч
выч
Наличие -взаимодействия
объясняется реализацией в системе прямого полярного сопряжения.
Введение в
пара-положение по отношению к альдегидной группе метиламинной группы, которая
является сильным донором электроновприводит к повышению расчетной величины
дипольного момента и к отсутствию эффекта взаимодействия, как и в случае
м-нитробензальдегида. Это является свидетельством отсутствия в системе прямого
полярного сопряжения.
Для подтверждения
сделанных нами предположений были сняты ИК - спектры этих соединений.
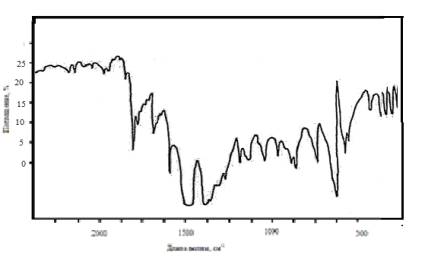
Рис.1 ИК- спектр
м-нитробензальдегида
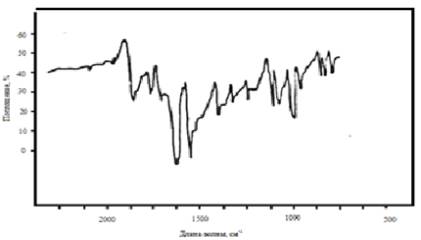
Рис.2 ИК- спектр п-нитробензальдегида
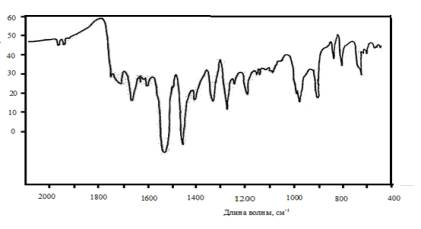
Рис. 3 ИК- спектр
п-диметиламинобензальдегида
ИК-спектры возникают в
результате возбуждения колебаний атомов и целых группировок в молекуле в
результате поглощения тепловых квантов энергии, расположенных от 760 нм
(граница ИК-спектров с видимой областью) до 200 см -1 (граница с
вращательными спектрами). Область от 200 до 10-1 см относится к
длинноволновой ИК-спектроскопии (ДИК), в которой проявляются вращательные
движения молекул [6].
При невысоких
температурах все молекулы пребывают в состоянии, характеризуемом нулевым
квантовым числом (![]() = 0) Эта остаточная энергия молекулы не исчезает даже
при абсолютном нуле. В ИК-спектроскопии разрешены, а значит имеют достаточную
интенсивность, полосы поглощения тепловых квантов.
= 0) Эта остаточная энергия молекулы не исчезает даже
при абсолютном нуле. В ИК-спектроскопии разрешены, а значит имеют достаточную
интенсивность, полосы поглощения тепловых квантов.
При введении
заместителей мы наблюдали изменения характеристической частоты альдегидной
группы.
Характеристические
частоты альдегидной группы, связанные с бензольным кольцом, лежат в пределах
1715 - 1695 см -1 [7].
В ИК-спектре молекулы
м-нитробензальдегида, где предполагается прямое сопряжения, вместо полосы 1715
см -1, появляется полоса 1608 см -1, которая отсутствует
в спектрах п-нитробензальдегида и п-диметиламинобензальдегида.
Это является
свидетельством электронных взаимодействий, происходящих в рассматриваемой молекуле.
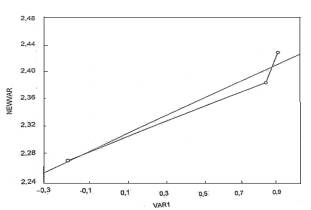
Используя полученные экспериментальные значения
дипольных моментов для бензальдегидов замещенных впара - положении и
литературные данные по а - константам провели расчет уравнения на компьютере Acer с процессором Pentium 4 и получили
зависимость
Рис.4 График корреляционной зависимости между
σ – константой Гамета и дипольным моментом
На
основании полученных данных по дипольным моментам для м-нитробензальбегида
можно предположить реализацию в этой молекуле прямого полярного сопряжения.
В
молекуле м-нитробензальдегида предположительно существует эффект электронного
взаимодействия.
Наличие
электронных взаимодействий в молекуле м-нитробензальдегида подтверждаются
данными ИК- спектров.
Литература:
1.
Определение дипольного
момента в разбавленных растворах (Метод Дебая), метод.рекомендации. Иркутск,
ИГУ, 2005г. с.16.
2.
Галямова И.Р. Дипольный
момент молекулы и связи. Доклад М., МГТУ им. Баумана, 2001г.
3.
Установление структуры
органических соединений физико-химическими методами. Пер. с анл. //под
редакцией Я.М. Варшевского и И.Ф. Лущенко //М. Химия, 1967 г., с.22.
4.
www.phvsdep.isu.ru 25.04.10.
5.
www.neftlib.ru neft-slovar-list1312
01.06.10.
6.
Иоффе Б.В. Физические
методы определения строения органических соединений. Л, ЛГУ, 1976г., с.7.
7.
Беллами Л. ИК-спектры
сложных молекул. М., Химия, 1963 г., 590 с.