Медицина
К.
мед.н. Пеннер
В.А., к.мед.н. В.В. Борисенко, к.мед.н.
Ковалева И.С.⃰
ГУ:
«Луганский
государственный медицинский университет», Украина
Кафедра нервных
болезней и нейрохирургии,
кафедра семейной медицины⃰
МИНЕРАЛЬНАЯ ПЛОТНОСТЬ КОСТЕЙ НИЖНИХ
КОНЕЧНОСТЕЙ ПРИ ДИАБЕТИЧЕСКОЙ ПОЛИНЕЙРОПАТИИ
Сахарным диабетом страдает более 170
миллионов человек во всем мире.
Болезненная диабетическая полиневропатия -
одно из наиболее тяжелых осложнений диабета,
являющихся результатом гипергликемии. От 13 до 70 % всех диабетиков имеют это осложнение и делают ее самой распространенной из форм диабетической
полиневропатии. Клеточные и
молекулярные механизмы взаимодействия периферической нервной системы с костным
метаболизмом до сих пор мало изучены.
Цель работы:
оценить минеральную плотность костной ткани (МПКТ) у женщин в
постменопаузальном периоде, страдающих сахарным диабетом (СД) 2 типа и
диабетической периферической полиневропатией.
Материал и методы исследования. Было обследовано 51
женщину с установленным диагнозом «Сахарный диабет второго типа», средний возраст которых составил 54,7 ± 2,49
года, из них у 29 была диагностирована дистальная полинейропатия нижних
конечностей. Контрольную группу составили
25 женщин, средним возрастом
52,2 ± 2,15 года, не имеющих в
анамнезе заболеваний и
состояний, приводящих к
изменению МПКТ. Обследование
проводили по единому диагностическому алгоритму: клинико-неврологический
статус, определение степени выраженности болевого синдрома по визуальной
аналоговой шкале (ВАШ) от 1 до 10 баллов, комплексный болевой опросник (КБО),
опросник DN4, шкала NISLL. Минеральную плотность костной ткани
определяли с помощью двойного рентгеновского остеоденситометра
"Prodigy" (GE Medical Systems). Индекс качества кости (Trabecular Bone Score, TBS), был определен при помощи программы Med-IMAPs Insight, Франция.
Результаты. МПКТ была значительно ниже у пациентов с СД
2 типа и дистальной полиневропатией нижних конечностей по сравнению с пациентами без полинейропатии и контролем: 0,63±0,02 против 0,83 ±0,05 (p=0,021) и 0,63±0,02 против 1,03 ± 0,2 (p=0.045), что
подтверждает негативное влияние дистальной диабетической полинейропатии на
костный обмен. В будущем мы планируем продолжить
исследования по данной проблеме с увеличением количества обследованных больных,
с учетом сопутствующих заболеваний, и проследить корреляционные взаимоотношения
минеральной плотности костной ткани с
интенсивностью болевого синдрома, чтобы определить диагностическую ценность
результатов для персонифицированных подходов к лечению и предупреждению
возможных осложнений сахарного диабета.
Results: Plasma NOx levels were significantly
higher in patients with painful diabetic neuropathy compared to healthy
volunteers: 45.8±7.6µM vs. 28.0±3.1µM (student's t-test p=0.045). The plasma
nitrotyrosine levels were doubled in patients with painful diabetic neuropathy
compared to healthy volunteers: 178.3±11.0µM vs. 89.0±16.5µM (student's t-test
p=0.0004).
Conclusions: Both indicators of nitrosative
damage were significantly elevated in patients diagnosed with diabetic
neuropathy. Nitrotyrosine levels were most significantly increased, possible
due to its greater stability and longer half-life. Future research will expand
on these observations and include correlations with pain intensity scores (NRS
and NPSI) to determine the diagnostic value for personalized healthcare
approaches with anti-nitrosative stress therapies.
Session: POSTER ABSTRACT PRESENTATION - THURSDAY
AM
Date/Time: Thursday, August 30, 2012 9:45 AM -
10:45 AM
Цель Исследования{Расследования}: Диабет
затрагивает более чем 170 миллионов человек глобально. Болезненная
диабетическая многоневропатия - одно из более изнурительных осложнений,
являющихся результатом гипергликемии, затрагивая 13-26 % всех диабетиков и
делая это самая распространенная болезненная невропатия в Западном обществе. pathogenesis невропатии,
вызванной гипергликемией вовлекает увеличение в окислительный и напряжение nitrosative, затрагивающее
микроваскулатуру, причиняя ишемию нейронала и смерть ячейки нейронала. Есть
свидетельство{очевидность}, что плазма nitrotyrosine уровни, индикатор напряжения nitrosative, увеличена в
моделях животного болезненной диабетической невропатии, и то выражение азотной
окиси synthase в
оборотных макрофагах увеличено в пациентах с болезненной диабетической
невропатией по сравнению с теми с неболезненной диабетической невропатией.
Цель этого изучения состояла в том, чтобы
измерить уровни nitrosative связанных с напряжением побочных продуктов nitrotyrosine и нитрита/нитрата (NOx) в плазме пациентов, сокрушенных болезненной
диабетической невропатией, чтобы определить, отличались ли они от здоровых
пациентов и типа II диабетиков без боли. Выражение азотной окиси synthase было также
измерено и сравнилось между пациентами. Окончательная цель изучения состояла в
том, чтобы определить, могла ли бы эта информация использоваться для
персонифицированного подхода здравоохранения идентифицировать пациентов,
которые извлекли бы выгоду больше всего из терапии напряжения anti-nitrosative.
Методы: Плазменные и целые образцы крови были
получены под этическим согласием от 129 пациентов, диагностированных с
болезненной диабетической невропатией, 40 здоровыми добровольцами и 40
пациентами, диагностированными с типом II диабета. Уровни NOx были оценены, используя Griess метод после сокращения
нитрата к нитриту с редуктазой нитрата. Плазма nitrotyrosine была оценена, используя соревнование ELISA испытание (Millipore, США).
Выражение иммунной{свободной} азотной окиси synthase (NOS2A) было оценено количественным PCR после того, как полная РКН
была извлечена из целых образцов крови и перемены, расшифрованной к cDNA.
Результаты: Плазма NOx уровни была значительно выше в пациентах с
болезненной диабетической невропатией по сравнению с здоровыми добровольцами:
45.8±7.6µM против 28.0±3.1µM (t-испытание студента p=0.045). Плазма nitrotyrosine уровни была
удвоена в пациентах с болезненной диабетической невропатией по сравнению с
здоровыми добровольцами: 178.3±11.0µM против 89.0±16.5µM (t-испытание студента
p=0.0004).
Заключения: индикаторы Both
повреждения{ущерба} nitrosative были значительно подняты в пациентах, диагностированных с диабетической
невропатией. Nitrotyrosine уровни были наиболее значительно увеличены, возможным из-за его большей
стабильности и более длинной полужизни. Будущее исследование подробно остановится
на этих наблюдениях и включит корреляции с множеством интенсивности боли
(НОМЕРА и NPSI), чтобы
определить диагностическую ценность для персонифицированных подходов
здравоохранения с терапиями напряжения anti-nitrosative.
Проблеме болевых синдромов при сахарном диабете
посвящено множество исследований. Диабет затрагивает более чем 170 миллионов
человек глобально. Болезненная диабетическая многоневропатия - одно из более
изнурительных осложнений, являющихся результатом гипергликемии, затрагивая
13-26 % всех диабетиков и делая это самая распространенная болезненная
невропатия в Западном обществе.Остеопороз в настоящее время называют "молчаливой
эпидемией", так как до пояления его осложнений - переломов костей он
протекает практически бессимпотомно. Это заболевание чаще встречается у женщин
в постменопаузальный период и именно боли в костях мышцах и конечностях,
заставляют пациентов обратиться к специалисту.
В последние годы эндокринологи обратили особое
внимание на распространенность остеопороза у больных сахарным диабетом и
назвали остеопороз «недооцененным осложнением сахарного диабета» или
«незамеченной болезнью при сахарном диабете». Так, в США у женщин старше 50 лет
с сахарным диабетом 1-го типа относительный риск частоты переломов шейки бедра
в 7 раз и более превышает таковой у женщин без диабета. У женщин с сахарным
диабетом 2-го типа в период менопаузы риск переломов шейки бедра почти в 2 раза
выше, чем у женщин, которые не страдают диабетом. Многочисленные исследования
доказали, что потеря костной массы наблюдается чаще и более выражена при
сахарном диабете 1-го типа, чем при диабете 2-го типа.
Следует учитывать, что инсулин принимает
непосредственное участие в процессах костеобразования. Кроме того, он влияет на
продукцию инсулинподобного фактора роста, который также участвует в образовании
костной ткани. Установлена некоторая стабилизация костной массы у больных
сахарным диабетом 1-го типа при инсулинотерапии, обеспечивающей максимально
возможную нормализацию уровня глюкозы в крови.
Среди предполагаемых механизмов ускоренного
развития остеопороза большое значение придают диабетическим поражениям мелких
кровеносных сосудов — микроангиопатиям, ухудшающим кровоснабжение костей.
Повышенное выделение кальция с мочой — фактор риска развития остеопороза. Это
явление отмечается у больных сахарным диабетом 1-го и 2-го типов при
некомпенсированном нарушении углеводного обмена, то есть при неправильном
лечении диабета. Возможно, этот фактор является одним из основных в учащении
случаев остеопороза при сахарном диабете.
Особо следует выделить возникновение остеопороза
у части больных диабетической нефропатией, при которой нарушается образование в
почках активных форм витамина D. Последние регулируют обмен кальция,
способствуя его всасыванию из кишечника и отложению в костях. Следовательно,
при диабетической нефропатии может снижаться минеральная плотность костей и
масса костной ткани, что характерно для остеопороза.
Учащение переломов костей (позвонки, шейка
бедра, лучевая кость, предплечье и др.) при сочетании сахарного диабета и
остеопороза связано также с увеличением случаев падения этих больных. К
факторам риска, приводящим к падениям, относят:
— эпизоды выраженного снижения уровня глюкозы в крови (гипогликемии);
— нарушение равновесия в связи с поражением нижних конечностей при
диабетической периферической нейропатии и/или синдроме диабетической стопы;
— резкое снижение артериального давления при сердечно-сосудистой форме
диабетической автономной нейропатии;
— ухудшение зрения в связи с диабетическим поражением глаз — ретинопатией и/или
катарактой.
Таковы современные сведения о связи между
сахарным диабетом и остеопорозом.
МИНЕРАЛЬНАЯ
ПЛОТНОСТЬ КОСТЕЙ НИЖНИХ КОНЕЧНОСТЕЙ
ПРИ
ОСЛОЖНЕНИЯХ САХАРНОГО ДИАБЕТА
Л.В. Кочетова, А.Б. Куликова, Ю.В. Котловский, В.В. Козлов, Т.А. Соколова
Красноярский
государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого,
ректор
– д.м.н., проф. И.П.Артюхов; кафедра общей хирургии, зав. – д.м.н., проф.
Ю.С.Винник;
кафедра
общественного здоровья и здравоохранения с курсом ПО, зав. – к.м.н., доцент
А.В. Шульмин;
Центральная
научно-исследовательская лаборатория, зав. – д.м.н., проф. Ю.В. Котловский.
Минеральная
плотность кости (МПК) снижается в зависимости от длительности заболевания
сахарным диабетом (СД). На нижних конечностях изменения МПК более выражены и
появляются значительно раньше, чем на костях верхних конечностей. Локальное
нарушение процессов резорбции и ремоделирования в костях голени и стопы, по
всей видимости, является одним из патогенетических звеньев развития синдрома
диабетической стопы и диабетической остеоартропатии (ДОАП).
По
официальным данным Всемирной организации здравоохранения, 6,4 % населения
земного шара страдают сахарным
диабетом. Ежегодно регистрируется более 600 тысяч вновь выявленных случаев заболевания, а каждые 15 лет число
больных сахарным диабетом удваивается. В 2010 году в мире насчитывалось 285
млн. больных сахарным диабетом (СД), а к 2030 году их количество увеличится до
439 млн. [1].
Диабетическая
остеоартропатия (ДОАП) одно из поздних осложнений сахарного диабета,
возникающее на фоне выраженной диабетической нейропатии, медиакальциноза, и
асептической деструкции костного скелета стопы. Частота развития ДОАП
колеблется от 1,5% среди всех больных сахарным диабетом и до 30% среди пациентов с диабетической
нейропатией [1]. Продолжительность жизни больных сахарным диабетом растет, в
результате увеличивается и частота
ДОАП. Несмотря на то, что характерные изменения при ДОАП были описаны более ста
лет назад, до сих пор не существует однозначного мнения о распространенности,
патогенезе и тактике лечения этой патологии [6] .
В
развитии ДОАП ключевую роль играют моторная и сенсорная нейропатия, травмы,
включая микропереломы, дезинтеграция суставов, и воспалительная реакция,
сопровождающаяся увеличением экспрессии цитокинов [2]. Предшествующая травме
остеопения не является доказанным фактором. В острой стадии ДОАП очевидным
является разобщение процессов костной резорбции и костеобразования [3].
Дисбаланс ремоделирования кости при сохранении нагрузки на конечность приводит
к изменениям как количества, так и качества костной ткани, что ведет к снижению
прочности кости [4]. Большинство исследователей считают, что наиболее тяжелая
степень остеопенического синдрома развивается у больных, с длительностью
сахарного диабета более 10 лет [5]. Работ, посвященных изучению состояния
костной ткани у больных сахарным диабетом в зависимости от сроков заболевания и вида осложнений,
практически нет [4]. В настоящее время для диагностики остеопороза используются
преимущественно неинвазивные методы, которые легко выполнимы, безопасны и могут
повторяться неоднократно у одного и того же больного. С целью ранней
диагностики остеопороза применяются различные технологии, объединенные под
общим названием «костная денситометрия», с ее помощью можно определить
минимальную плотность костной ткани (МПК), являющуюся главным критерием
прочности кости.
Цель:
исследовать минеральную плотность костей у больных сахарным диабетом типа 2 в
зависимости от длительности заболевания.
Материалы
и методы
Работа
выполнена на базе кафедры общей хирургии, в терапевтическом и хирургическом
отделениях Дорожной клинической больницы на ст. Красноярск и ЦНИЛ КрасГМУ.
Обследовано 66 больных сахарным диабетом типа 2, в возрасте от 42 до 84 лет, средний
возраст больных составил 62,5 (57,0; 72,0) года. В качестве контроля служили
данные МПК 30 условно здоровых людей
аналогичного возраста. В зависимости от срока заболевания и клинических проявлений больные СД
были разделены на 3 группы. В первую группу вошло 16 больных без синдрома диабетической стопы
(СДС) с давностью заболевания до 5 лет. Средний возраст этих больных составил
60,0 (41,25; 69,0); длительность заболевания – 5,0 (1,25; 7,75). Во вторую
группу вошли 19 больных с синдромом
диабетической стопы, давностью заболевания 10,0 (6,0; 15,0), средний возраст –
66,0 (60,0; 74,0). Третью группу составил 31 больной с признаками диабетической
остеоартропатии и давностью заболевания
свыше 10 лет, средний возраст больных – 62,0 (58,0; 73,0), длительность
заболевания 14,0 (9,0; 20,0). Характер поражения стоп больных СД, осложненным
синдромом диабетической стопы представлен в табл.
1.
В исследование не включены больные, принимающие глюкокортикостероиды, имеющие в анамнезе переломы и заболевания,
приводящие к снижению МПК.

Обследование
больных проводили по программе, которая предусматривала общепринятые
клинические и лабораторные методы исследования, педологический осмотр с оценкой
состояния периферической иннервации и кровоснабжения. При наличии язвенного
дефекта или остеоартропатии выполняли рентгенографию костей голени и стоп. С
целью исключения диабетической ретинопатии все больные осматривались окулистом.
Нейроостоартропатию
диагностировали на основании типичной
рентгенологической картины, явлений
асептической деструкции костей стоп в типичных местах биомеханического
нагружения и наличия симптомов
периферической нейропатии, которые определялись при помощи микрофиламента по методике Zigber-Carvile.
Исследование МПК
выполняли на ультразвуковом денситометре фирмы «Omnisense 7000S» (США) в
нижней трети лучевой кости и нижней трети большеберцовой кости. Оценку
результатов МКП проводили согласно методическим рекомендациям Международного общества по клинической
денситометрии (ISCD – 2003; 2005;2007). У женщин до 55 лет и у мужчин до 21
года вычисляли Z-индекс – отношение конкретного показателя к данным у здоровых
людей аналогичного возраста; у женщин после 55 лет и у мужчин после 20 лет
определяли Т-индекс – отношение полученных результатов к возрастной группе
21-25 лет.
Статистическую
обработку данных выполняли с применением пакета прикладных программ «SPSS
19.0», возможностей Microsoft
Excel.
Проверка
нормальности распределения значений переменных в группах наблюдения проводилась
с использованием критерия Шапиро-Уилкса. Описательная статистика
параметрических учетных признаков представлена в виде средних арифметических
(М) и стандартных ошибок средних. В
случаях отсутствия нормального распределения переменных, в описательной
статистике использовались медиана (Ме) и перцентили (Р25, Р75). При наличии
нормального распределения переменных проверку статистической значимости
различий между исследуемыми группами производили с использованием
дисперсионного анализа с попарной оценкой выборок по апостериорному критерию
Шеффе.
Для
оценки значимости статистических различий при отсутствии нормального
распределения, проводили сравнение групп по непара-метрическому критерию
Краскела-Уолеса, с последующим попарным тестированием групп по критерию
Манна-Уитни. Различия во всех случаях оцени-вали, как статистически значимые
при р<0,05.
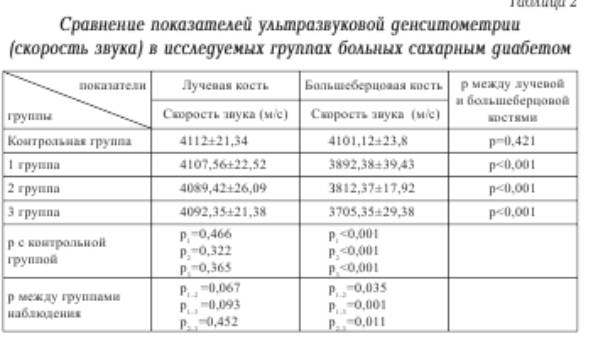
Результаты и обсуждение. В
результате проведенного исследования выявлено, что у лиц контрольной группы
денситометричкские показатели МПК на
лучевой кости статистически значимо не отличались от показателей
большеберцовой кости.
Изменения
МПК у больных сахарным диабетом зависят от давности заболевания. У больных
сахарным диабетом с давностью заболевания более десяти лет достоверно снижается
скорость звука на большеберцовой кости по сравнению с контрольной группой.
Обращает на себя внимание, что скорость
звука на большеберцовой кости у этих больных статистически значимо меньше чем у
больных сахарным диабетом с давностью заболевания до 5 лет (р=0,011). В то же
время показатели скорости звука на лучевой кости у больных сахарным диабетом третьей группы статистически значимо не
отличаются от показателей
контрольной, первой и второй группы больных сахарным диабетом (табл. 2).
Обращает
на себя внимание тот факт, что на лучевой кости показатели скорости звука
статистически значимо не изменяются, в то время как на большеберцовой
кости они значительно снижаются, причем
тенденция к снижению скорости звука на большеберцовой кости появляется через
пять лет от начала заболевания сахарным диабетом (р<0,001). По мере
увеличения длительности заболевания прогрессирующее снижение скорости звука
носит стати-стически значимый характер. Можно предположить, что изменения МПК у
больных сахарным диабетом начинаются с костей голени и стоп, так как Т-индекс и
Z-индекс больных сахарным диабетом на большеберцовой кости значительно меньше,
чем на лучевой кости даже у больных с длительностью заболевания до 5 лет (
табл. 3).
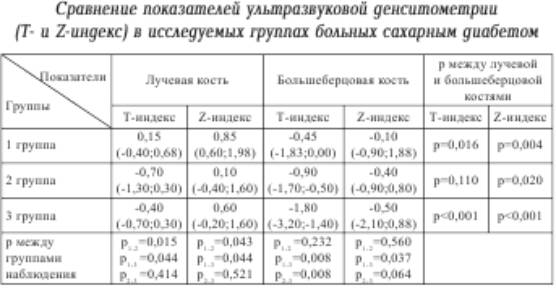
Статистически
значимые различия Т- и Z-индексов на лучевой кости начинают проявляться по
сравнению с первой группой наблюдения уже в группе пациентов с длительностью
течения сахарного диабета от 5 до 10 лет, в то время как на большеберцовой
кости, эти показатели становятся значимо отличимыми от первой группы позднее –
у пациентов с более чем десятилетним течением сахарного диабета и признаками
диабетической остеоартропатии (табл. 3). При этом, начиная с длительности
заболевания до 5 лет, значения всех денситометрических показателей при
сравнении лучевой и большеберцовой кости начинают приобретать статистически
значимые различия.
В
результате проведенного исследования выявлено, что у больных сахарным диабетом
изменения минеральной плотности кости начинаются с костей нижних конечностей.
Денситометрические показатели скорости звука, Т-индекс и Z-индекс на
большеберцовой кости у больных сахарным
диабетом с длительностью заболевания более десяти лет соответствуют признакам
остеопороза средней степени тяжести. Степень снижения МПК нижних конечностей
зависит от длительности заболевания.
Это является ос-нованием для выделения больных с длительностью заболевания
более 5 лет в группу риска по развитию
ДОАП и своевременного проведения профилактического лечения Больным с сахарным диабетом необходимо
проводить ультразвуковую денситометрию не менее одного раза в год для раннего выявления степени
деминерализации костей нижних конечностей.
BONE MINERAL DENSITY OF THE LOWER LIMBS
AT COMPLICATIONS OF DIABETES
L.V. Kochetova, A.B. Kulikova, Y.V. Kotlovsky,
V.V. Kozlov, T.A. Sokolova
Krasnoyarsk State Medical University named
after prof. V.F. Vojno-Yasenetsky
Abstract. Bone mineral density (BMD) is reduced depending
on the duration of diabetes (DM). At the lower limbs the changes
of BMD is more pronounced and occur much earlier than on the
bones of the upper limbs. The local disturbance of resorption
and remodeling in the leg and foot bones, apparently, is one of
the pathogenetic mechanisms of growth of diabetic foot and
diabetic osteoarthropathy (DOAP).
Key words: bone mineral density, diabetic foot syndrome,
diabetic osteoarthropathy, osteoporosis, osteopenia.
Литература
1. Аметов А.С., Доскина Е.В. Заболевания эндокринной
системы
и остеопороз // Рус. медиц. журн. – 2004. –
№17.
– С. 1130-1136.
2.
Белых О.А., Кочеткова Е.А., Гельцер Б.И. Состояние
кальций-фосфорного
обмена у больных сахарным диабетом
1
типа // Остеопороз и остеопатии. – 2005. – № 1.– С.12-15.
3.
Вербовая Н.И., Косарева О.В. Минеральная плотность
костной
ткани и ее метаболизм при сахарном диабете 2 типа
у
больных старших возрастных групп // Клинич. геронто-
логия.
– 2003. – Т .9, №4. – С. 14-17.
4.
Чечурин Р. Е., Аметов А. С. Сахарный диабет I типа и
остеопороз
(обзор литературы) // Остеопороз и остеопа-
тии.
– 1999. – № 1. – С. 2-5.
5. Мкртумян А.М. Оценка состояния костной ткани
у
больных
сахарным диабетом // Остеопороз и
остеопатии.
– 2007. – № 1. – С. 27-30.
6. Saito M., Marumo K. Collagen
crosslinks as a determinant
of bone quality: apossible explanation for bone fragility in
aging, osteoporosis, and diabetes mellitus // Osteoporosis
Int.
– 2010. – Vol. 21, № 2. – P. 195-214.