К.х.н. Рыжаков А.В., д.х.н. Андреев В.П., к.х.н. Соболев П.С.
Петрозаводский государственный университет, Россия
Координация
иона железа (III) с
гетероароматическими N-оксидами ряда пиридина
К
настоящему времени известны многочисленные донорно-акцепторные комплексы (ДАК)
гетероароматических N-оксидов с катионами металлов (v-акцепторы), представленными во всех группах
периодической системы Д.И.Менделеева. К наиболее стабильным относятся комплексы
n,v-типа разного состава с
катионами переходных металлов, таких как кобальт, никель, медь, цинк, ртуть,
платина. Эти комплексы выделены в твердом состоянии из различных органических
растворителей, т.к. в водных растворах
они разлагаются водой на исходные компоненты. В данных комплексах N-оксиды выступают в качестве n-доноров, то есть координируются с металлами атомом кислорода N-оксидной группы [1]. На фоне очевидных успехов в
исследовании ДАК N-оксидов с подобными металлами
весьма скромно выглядит изученность аналогичных комплексов с ионами железа.
Целью
данной работы явилось изучение координации N-оксида пиридина и его 4-замещенных
производных (Iа-д) с нитратом
железа (III) в водной среде.
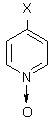
I (а-д)
Х= Н (а), СН3
(б), ОСН3 (в), СООН (г), N-морфолил (Iд)
Константы
устойчивости ДАК (Куст) и коэффициенты экстинкции (ε560)
полосы переноса заряда определяли при длине волны λ 560 нм (поглощение
комплексообразователя практически равно нулю) методом Бенеши-Гильдебранда [2]. Для этого в каждом опыте строили линейные
графические зависимости в координатах Са/D = f(l/Сд), где Са и Сд — концентрации акцептора и донора соответственно, D – оптическая
плотность, l — толщина
кюветы (см). Во всех случаях коэффициенты корреляции были не ниже 0,98.
Судя
по величинам Куст, образующиеся
комплексы относятся к слабым, но к более устойчивым, чем ДАК этих же N-оксидов с
катионами щелочных и щелочноземельных металлов [3], у которых значение Куст составляет от 0,04 до
0.53 л/моль. Особое место в ряду
выбранных нами N-оксидов
занимает соединение (Iд). Оно содержит очень сильную электронодонорную группу,
поэтому значения Куст и ε560 для него намного выше, чем для других соединений (Iа-г).
Заместители
в гетероциклическим кольце N-оксидов оказывают незначительное влияние на величины Куст и ε560 ДАК с катионом
железа (III) за исключением соединения (Iд). Наличие
электронодонорных заместителей — метильной,
метоксильной и N-морфолильной групп, как и следовало ожидать, облегчает
комплексообразование, но хорошей линейной корреляции Гаммета Куст от σ-констант
заместителей, характерной для большинства ДАК N-оксидов с другими акцепторами, в данном
случае не наблюдается.
Относительно строения изучаемых комплексов можно сделать
предположение, что как и большинство подобных ДАК с другими металлами, они
относятся к n,v-типу, то есть
координация осуществляется по атому кислорода N-оксидов. И только для N-оксида (I г) возможно
конкурентное связывание через карбоксильную группу, что может объяснить более
высокие значения Куст по сравнению с незамещенным
аналогом в результате смены
реакционного центра. Действительно, катион Fe3+ легко
координируется с карбоксильной группой карбоновых кислот [4].
Проведение
реакции N-оксида (Iа) с Fe(NO3)3 в
воде при различной температуре (285, 295 и 305 К) позволило определить
термодинамические параметры рассматриваемого процесса: энтальпию, энтропию,
свободную энергию Гиббса. Константа устойчивости ДАК возрастает с увеличением
температуры, что определяет положительную величину ΔН равную 24,8
кДж/моль. Это отличает данный процесс от большинства реакций образования
нестойких молекулярных комплексов, для которых повышение температуры
неблагоприятно, так как при этом происходит их диссоциация. Величина ΔG принимает
невысокие положительные значения, уменьшающиеся с повышением температуры: 1,89,
1,06 и 0,27 кДж/моль при 12, 22 и 32 оС соответственно, а
ΔS положительна -
0,080 кДж/моль·град.
Таким образом, N-оксиды ряда пиридина образуют с катионом железа (III) в воде слабые комлпексы предположительно n,v-типа (за счет атома кислорода)
состава 1:1, существующие только в растворе в равновесии со своими компонентами.
Эти комплексы являются более устойчивыми, чем комплексы этих же соединений с
катионами щелочных и щелочноземельных металлов. Наибольшей устойчивостью
обладает комплекс с N-оксидом (Iд) вследствие наличия
в молекуле мощного электронодонорного заместителя. Реакция комплексообразования
N-оксида пиридина с Fe(NO3)3 является эндотермической. Наличие
электронодонорных заместителей в гетероциклическом кольце, так же, как и
карбоксильной группы, способствует комплексообразованию. В последнем случае
возможна смена донорного центра за счет взаимодействия Fe3+ с СООН группой N-оксида. Планируется
изучение строения комплексов этого N-оксида, а также других исследованных соединений (Iа-в,
д).
Литература:
[1] Андреев В.П., Рыжаков А.В., Морозов
А.К., Алексеева О.О., Родина Л.Л.// ХГС.1995. № 6. С.760-773. DOI
10.1007/BF01169067
[2] Свердлова О.В. Электронные
спектры в органической химии. Л.:Химия, 1985. С. 202.
[3] Рыжаков А.В.,
Андреев В.П. // ЖОХ. 2005. Т. 75. Вып. 1. С. 133-136. DOI 10.1007/s11176-005-0182-5.
[4] Рипан Р., Четяну И. Неорганическая химия. М.: Мир, 1972. Т.2.С.528.