Жаппар Н.К., Шайхутдинов
В.М., Жакупов Е.Ж., Тен О.А., Балпанов Д.С.
Выделение
железо- и сероокисляющих бактерий перспективных при подземном выщелачивании
меди
Филиал РГП на ПХВ
«Национальный центр биотехнологии Республики Казахстан», КН МОН РК в г. Степногорск,
e-mail: ipbncbrk@mail.ru
Введение
Постоянно
истощающиеся запасы рентабельных месторождений вызывают необходимость
разработки новых высокоэффективных и экономически привлекательных методов
извлечения металлов из бедных месторождений [1, 2].
Анализ
мирового опыта использования скважинных технологий показал, что по сумме
положительных факторов преимущество пока остается за подземным выщелачиванием и
растворением, которым свойственны:
-
возможность освоения месторождения с рудами, нерентабельными для традиционных
способов их добычи ввиду низкого содержания полезного компонента, большой
глубины залегания и т.п.;
-
более низкая (на 20-30%) себестоимость добычи руды по сравнению с традиционными
способами (карьеры, шахты, штольни);
-
меньшие (в 2-5 раз) по сравнению с традиционными способами добычи затраты на
организацию производства;
-
более быстрая окупаемость инвестиций;
-
меньшие сроки строительства добычных комплексов;
-высокий
уровень автоматизации процессов;
- безопасные условия
труда;
- существенное
снижение негативного воздействия на окружающую среду.
Для
интенсификации процесса извлечения металла с различными целями могут вноситься
дополнительные вещества. Так, дополнительными химическими окислителями могут
быть привносимые оксиды металлов [3]. Кроме того, вносимыми добавками можно
стимулировать не только химическое, но и биологическое выщелачивание или
интенсифицировать рост аборигенных выщелачивающих бактерий. В последнем случае
применяются питательные вещества для сульфид-окисляющих бактерий [4].
При
биогидрометаллургии используется способность автотрофных бактерий (Acidithiobacillus ferrivorans,
Acidithiobacillus ferrooxidans, Acidithiobacillus thiooxidans и др.)
поглощать для своей жизнедеятельности энергию, выделяемую при окислении
сульфидов и тиосульфатов металлов, серы, а также при переходе Fe2+ в
Fe3+. Указанные бактерии содержат вещества, катализирующие эти
реакции. В результате образуется H2SO4 или соли Fe3+,
которые можно применять как реагенты для выщелачивания.
Таким образом, выделение новых штаммов
железоокисляющих и сероокисляющих бактерии открывает большие возможности для
развития технологии бактериального выщелачивания цветных металлов из бедных
руд.
Материалы и методы
Питательные среды
Среду Сильвермана и
Люндгрена 9К готовили путем смешения двух отдельных растворов:
1-й раствор: в 700 мл
дистиллированной воды добавляли (г): (NH4)2SO4 – 3,0; K2HPO4 – 0,5; KCl – 0,1; MgSO4x7H2O – 0,5; Ca(NO3)2x4H2O – 0,01.
2-й раствор: в 300 мл
дистиллированной воды растворили 44,2 г FeSO4x7H2O и добавили 1мл
10н раствора серной кислоты.
Среда Ваксмана, г/л:
Сера – 10,0; (NH4)2SO4 – 0,3; KH2PO4 – 3,0; CaCl2 x 6H2O – 0,25; MgSO4 x 7H2O – 0,5; FeSO4 x 7H2O – 0,01.
Растворы стерилизовали
отдельно при температуре 110 ![]() и 1 атм. в
течение 20 мин. Сера стерилизовалась отдельно – текучим паром в течение 1 ч.
и 1 атм. в
течение 20 мин. Сера стерилизовалась отдельно – текучим паром в течение 1 ч.
Выделение
чистых культур осуществляли на среде Сильвермана и Люндгрена 9К и Ваксмана[5].
Количественный
учет микроорганизмов проводили методом
серийных разведений и методом прямого
подсчета с помощью микроскопа «Zeiss
Standart 25» с фазово-контрастным устройством [6].
Идентификацию штаммов
проводили на основе физиолого-биохимических методов в соответствии с
определителем бактерий Берджи [7].
Величину рН и
окислительно-восстановительный потенциал (Eh) определяли с помощью анализатора
«Mettler Toledo Seven Multi S47-K».
Определение концентраций металлов проводили методом
атомной абсорбции [8] с
атомизацией в графитовой печи с использованием атомно-абсорбционного
спектрометра «Квант-2АТ».
Концентрацию ионов Fe3+
и Fe2+ в жидкой фазе определяли спектрофотометрическим методом на
колориметре «КФК-2» [9].
Видовую идентификацию
бактерий проводили на основе анализа нуклеотидной последовательности 16S rRNA гена с
использованием универсальных праймеров [10]. Секвенирование проводили с
применением набора «Big Dye Terminator v.3.1 Cycle Sequencing Kit» (Applied Biosystems)
согласно инструкции производителя. Разделение продуктов реакции секвенирования
осуществляли на автоматическом генетическом анализаторе «3730xl DNA Analyzer» (Applied Biosystems).
Для филогенетического анализа использовали программное обеспечение Mega 5.0.
Результаты и
обсуждение
При подземном выщелачивании
технологические растворы имеют температуры порядка 10-14 оС, в
летний период в южных регионах возможен их прогрев до 23-25 оС. В
связи с этим перспективно использование консорциума психрофильных и мезофильных
микроорганизмов, что позволит поддерживать высокую эффективность процесса в условиях
сезонных перепадов температур.
Разрушение сульфидных медных минералов
происходит как при непосредственном действии бактерий, так и под действием
ионов трёхвалентного железа, которые, окисляя минерал, переходят в
двухвалентную форму. Бактериальная регенерация активного окислителя происходит
под действием железоокисляющих бактерий. При разрушении сульфидов на
поверхности минералов образуется слой элементарной серы, который экранирует
действие окислителя. В связи с этим в процессах биовыщелачивания целесообразно
использование как железо- так и сероокисляющих микроорганизмов.
Для выделения
ацидофильных микроорганизмов был осуществлён отбор проб из месторождений:
Конырат (ТОО «Корпорация Казахмыс», Карагандинская область) и Кок-Кия
(Жамбылская область). В таблице 1 приведены данные анализа отобранных проб.
Таблица 1 – Результаты
общего химического анализа руд
|
Месторождение |
Определяемый элемент, г/т |
S, % |
|||||
|
Au |
Ag |
Cu |
Fе |
As |
общая |
сульфидная |
|
|
Конырат |
0,2 |
0,5 |
5410,4 |
30416,7 |
108,1 |
7,8 |
5,2 |
|
Кок-Кия |
1,1 |
0,6 |
3304,4 |
37233,3 |
2581,6 |
17 |
14,8 |
Согласно результатам химического анализа, в отобранных
образцах содержится достаточное для развития хемолитотрофных бактерий
количество железа и сульфидной серы.
Для получения накопительных культур
железоокисляющих бактерий отобранные пробы в количестве 5 г вносили в колбы со
100 мл среды 9K, содержащей в качестве
единственного источника энергии двухвалентное железо. Культивирование проводили на качалках при температурах 14 °С, 28 °С и
42 °С при 200 об/мин. В таблице 2 представлена динамика роста
накопительных культур хемолитотрофных бактерий.
Таблица 2 – Изменение физико-химических параметров среды в
накопительных культурах со средой 9К
|
Проба |
Режим культивирования |
Fe2+, г/л |
Fe3+, г/л |
Титр, клеток х 107 |
||
|
Исходное |
Конечное |
Исходное |
Конечное |
|||
|
Кок-кия |
14 °С |
8,75 |
0 |
0,38 |
9,21 |
1,28 ± 0,12 |
|
28 °С |
8,75 |
0 |
0,32 |
9,14 |
2,45 ± 0,37 |
|
|
42 °С |
4,6 |
4,6 |
0,24 |
0,29 |
- |
|
|
Конырат |
14 °С |
8,75 |
0 |
0,48 |
9,32 |
1,52 ± 0,17 |
|
28 °С |
8,75 |
8,62 |
0,53 |
0,55 |
- |
|
|
42 °С |
4,6 |
4,6 |
0,52 |
0,48 |
- |
|
По данным таблицы
2 видно, что при культивировании проб месторождений Кок-кия и Конырат при температурах
14 °С и 28 °С произошло полное окисление двухвалентного железа, что говорит о
присутствии психротолерантных и мезофильных железоокисляющих микроорганизмов.
По микроскопии обнаруженные культуры представлены мелкими, подвижными
палочковидными клетками. При температуре 42 °С не выявлены признаки жизни
микроорганизмов и окисления двух валентного железа, что говорит об отсутствии
умеренно термофильных железоокисляющих микроорганизмов в этих образцах
Для получения накопительных культур сероокисляющих бактерий отобранные
пробы в количестве 5 г вносили в колбы со 100 мл среды Ваксмана, в качестве единственного источника
энергии для бактерий использовали элементарную серу. Культивирование
проводили на качалках при температурах 14 °С, 28 °С и 42 °С при 200 об/мин. В таблице
3 представлена динамика роста накопительных культур сероокисляющих
хемолитотрофных бактерий.
Таблица 3 – Изменение физико-химических параметров среды в накопительных
культурах со средой Ваксмана
|
Проба |
Режим культивирования |
Исходное рН |
Конечное рН |
Титр, клеток х 107 |
|
Кок-кия |
14 °С |
5,5 |
5,45 |
- |
|
28 °С |
5,5 |
5,4 |
- |
|
|
42 °С |
5,5 |
5,4 |
- |
|
|
Конырат |
14 °С |
5,5 |
5,45 |
- |
|
28 °С |
5,5 |
1,8 |
2,45 ± 0,37 |
|
|
42 °С |
5,5 |
5,4 |
- |
При культивировании
проб месторождений Конырат при 28 °С произошло снижение уровня рН, что
указывает на наличие мезофильных бактерий, окисляющих серу. Обнаруженные по
микроскопии культуры представлены мелкими, подвижными палочковидными клетками.
В накопительных
культурах при температурах 14°С и 42°С отсутствовали признаки наличия
психротолерантных и умеренно-термофильных сероокисляющих бактерий – не
произошло снижение рН. В образце проб месторождения Кок-кия сероокисляющие бактерии не обнаружены.
Для выделения
чистых культур психротолерантных и мезофильных бактерий были проведены рассевы
методом предельных десятикратных разведений на среде 9К для железоокисляющих и
среде Ваксмана с элементарной серой для сероокисляющих бактерий. Пробирки с
рассевами культивировали при 14 °С и 28 °С.
В результате
были получены 2 изолята психротолерантных железоокисляющих бактерий: из
месторождения Кок-кия – изолят Kok и из
месторождения Конырат – изолят KP,
2 изолята
мезофильных железо- (изолят KokM) и сероокисляющих (изолят KS) бактерий.
Далее была проведена физиолого-морфологическая идентификация изолятов согласно
определителю Берджи (таблица 1).
Таблица 1 – Физиолого-морфологические
признаки выделенных изолятов
|
Признаки |
Изолят Kok |
Изолят KP |
Изолят KokM |
Изолят KS |
|
Форма и размер клеток, мкм |
палочка, |
палочка, |
палочка, 0,4-0,5х1,3-1,6 |
палочка, |
|
Тинкториальные свойства |
грамотр-ый |
грамотр-ый |
грамотр-ый |
грамотр-ый |
|
Источники энергии для роста |
Fe2+, сульфидные
минералы |
Fe2+, сульфидные
минералы |
Fe2+, сульфидные
минералы |
S, сульфидные минералы |
|
Пределы рН |
1,4-3,5 |
1,3-4,0 |
1,4-4,0 |
0,8-3,5 |
|
Отношение к О2 |
строгий аэроб |
строгий аэроб |
строгий аэроб |
строгий аэроб |
|
Температура для роста ᵒС |
8-25 °C |
8-25 °C |
20-35 °C |
20-35 °C |
С целью
подтверждения физико-химической идентификации и определения филогенетического
родства выделенных изолятов было проведено секвенирование нуклеотидной
последовательности фрагмента гена 16S рРНК и сравнение полученных
последовательностей с последовательностями из базы данных BLAST. Согласно
полученным данным, изоляты Kok и KP были отнесены к Acidithiobacillus ferrivorans вследствие высокой степени
гомологии на уровне 99% со штаммом Acidithiobacillus ferrivorans SS3. Изоляты
KokM и KS были отнесены к Acidithiobacillus ferrooxidans и Acidithiobacillus thiooxidans соответсвенно.
Филогенетическое
дерево представлено на рисунке 1.
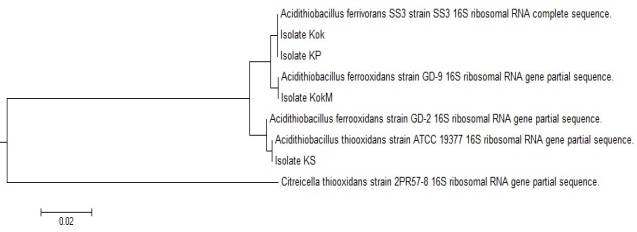
Рисунок 1 – Филогенетическое
дерево, построенное с использованием алгоритма neighbor-joining на основе
сравнения нуклеотидных последовательностей генов, кодирующих 16S рРНК
Таким образом, на
основе физиолого-биохимических исследований и филогенетического анализа выделенные изоляты были идентифицированы как Acidithiobacillus ferrivorans Kok, Acidithiobacillus ferrivorans
KР, Acidithiobacillus ferrooxidans KokM и Acidithiobacillus thiooxidans KS. Все выделенные штаммы депонированы
в Депозитарии ТОО «Казахский научно-исследовательский институт перерабатывающей
и пищевой промышленности».
Выделенные штаммы занесены в коллекцию
филиала «Национальный центр биотехнологии» в г. Степногорске в качестве перспективных бактерий для выщелачивания
цветных металлов из сульфидных руд.
Литература:
1. Муканов Д. Металлургия
Казахстана: состояние, инновационный потенциал, тренд развития. –
Алматы, 2005. – Т. 5. – 290
2. Заболотцкий А.И.,
Докунин Ю.В. Первый в РФ опыт промышленной добычи золота способом подземного
выщелачивания из золотоносных кор выветривания Гагарского месторождения //
ГИАБ. – 2009. – № 1. – С. 391-402.
3.
Заболотцкий А.И., Заболотцкий К.А., Ситников
Т.И., Ященко И.Э. Предварительные результаты отработки опытно-промышленных
блоков скважинного подземного выщелачивания меди на Тумашевском месторождении
// Горная Промышленность. – 2008. – №5 (81) . –
С. 1-8.
4. Ostrowski M, Sklodowska A. Bacterial and chemical leaching pattern on
copper ores of sandstone and limestone type. // World J. Microbiol. Biotechnol.
– 1993. - № 9. –Р. 328-333.
5. Биогеотехнология
металлов / Г.И. Каравайко [и др.] – М.: Внешторгиздат, 1989. – С. 51–54.
6. Герхардт, Ф. Методы
общей бактериологии / Ф. Герхардт. – М.: Мир, 1984. – С. 450–454.
7. Хоулт, Д.Ж. Определитель
бактерий Берджи / Д.Ж. Хоулт [и др.] –
М: Мир, 1997. – 588 с.
8. Гарифзянов, А.Р.
Эмиссионная фотометрия пламени и атомно-абсорбционная спектроскопия / А.Р.
Гарифзянов. – Казань, 2009. – 94 с.
9. Vogel, A.I. Vodel’s textbook of quantitative chemical / A.I. Vogel. –
London, 1989. – 690 p.
10.
Lane, D.J. Nucleic acid techniques
in bacterial systematics / D.J. Lane. – Chichester: John Wiley & Sons, –
1991. P.115–175.