Аминджанов А.А,. Хасанов Ф.Н., Баходуров
Ю.Ф., Бекназарова Н.С
Таджикский
национального университета, Душанбе, Таджикистан
E-mail: azimjon51@mail.ru farrukh.19@mail.ru
КОМПЛЕКСООБРАЗОВАНИЕ МЕДИ(II) С 1-ФЕНИЛ-2,3-ДИМЕТИЛПИРАЗОЛИН-5-ТИОНОМ
В СРЕДЕ 6 МОЛЬ/Л HCI ПРИ 328К
Исследован
процесс комплексообразования меди(II) c 1-фенил-2.3-диме-тилпиразолин-5-тионом в среде 6 моль/л
НСI при 328К.
Установлено, что Сu(II) с этим лигандом образует четыре комплексные формы.
Определены значения констант образований всех
комплексов образующихся в изученной системе.
Ключевые
слова: Медь(II) -
комплексообразование - 1-фенил-2,3-диме-тилпиразолин - 5- тион - константа
устойчивости – раствор.
Медь в
степени окисления +2 имея электронную конфигурацию 3d9 легко
деформируется и образует устойчивые координационные соединения с серусодержащими
лигандами. Большинство комплексов меди(II) имеют октаэдрическую структуру в которой четыре координационные места заняты
лигандами, расположенными к металлу ближе, чем два других лиганда, находияшихся
выше и ниже металла [1]. Интерес к химии координационных соединений меди(II) из года в года возрастает, поскольку медь будучи
биоактивным металлом образовывает в различных степенях окисления в особенности
в степени окисления +2 комплексы с биоактивными лигандами, в частности с
производными пиразолина. Одним из производных пиразолина является 1-фенил-2,3-диметилпиразолин-5-тион
с которым ранее нами был изучен процесс коплексообразования меди(II) в среде 6 моль/л НСI при 273 К [2]. Целью настоящей работы явилось исследования процесса
комплексообразования меди(II) c 1-феныл-2,3-диметылпиразолин-5-тион в среде 6 моль/л
НСI при 328К.
Экспериментальная часть
В
качестве исходных использовали CuCI2∙H2O марки «чда» и 1-фенил-2,3-ди-
метилпиразолин-5-тион,
который был синтезирован в соответствии с методикой, описанной в [3]. Потенциометрическое титрование
проводили c использованием компаратора
напряжения Р-3003М1. Точность поддержания температуры составляла ![]() 0.10С. Различную концентрацию окисленной и восстановительной
форм 1-фенил-2,3-диметилпиразолин-5-тиона создавали окислением его части в
среде 6 моль/л HCI 0.1 N раствором J2.
Индикаторным электродом служила платиновая пластинка. В качестве электрода
сравнения использовали хлорсеребряный электрод. Расчёт равновесной концентрации
лиганда в каждой точке титрования проводили по уравнению
0.10С. Различную концентрацию окисленной и восстановительной
форм 1-фенил-2,3-диметилпиразолин-5-тиона создавали окислением его части в
среде 6 моль/л HCI 0.1 N раствором J2.
Индикаторным электродом служила платиновая пластинка. В качестве электрода
сравнения использовали хлорсеребряный электрод. Расчёт равновесной концентрации
лиганда в каждой точке титрования проводили по уравнению
![]()
![]() , (1)
, (1)
где Еисх - исходный равновесный
потенциал системы в отсутствие меди(II); Еi - равновесный
потенциал системы в данной точке титрования; СL– исходная аналитическая концентрация лиганда; Vисх/Vобщ – отношение исходного объё-ма системы к
общему; Т - температура проведения опыта.
Функцию образова-ния ![]() находили по уравнению
находили по уравнению
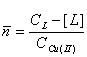 (2)
(2)
Все расчеты по
определению функции образования, равновесной концен-трации лиганда, уточнению
констант образований, мольных долей проводили с использованием компьютера на
языке программирования Excel, Borland Delphi,
операционная система Windows 7.
Результаты и их обсуждения
В табл.1 представлены полученные
экспериментальные данные по определению функции образования хлоро -
1-фенил-2.3-диметилпиразолин-5-тионных комплексов меди(II) в среде 6 моль/л HCI при 328К.
Таблица 1
Определение функция
образования комплексов меди(II) с
1-фенил-2,3-диме-тилпиразолин-5-тионом в среде 6 моль/л HCI при 328К. СисхСu(II)=0.1моль/л; СLисх=0.01моль/л
до окисления йодом
|
ΔE,мВ |
CL·103моль/л |
CCu·103моль/л |
-Lg[L] |
|
|
1 |
2 |
3 |
4 |
5 |
|
17,3 |
9,88 |
1,17 |
2,273 |
3,87 |
|
19,0 |
9,84 |
1,55 |
2,300 |
3,09 |
|
23,5 |
9,80 |
1,94 |
2,370 |
2,85 |
|
26,0 |
9,76 |
2,32 |
2,409 |
2,52 |
|
33,7 |
9,73 |
2,69 |
2,528 |
2,50 |
|
37,2 |
9,69 |
3,07 |
2,583 |
2,30 |
|
42,4 |
9,65 |
3,44 |
2,664 |
2,17 |
|
46,5 |
9,61 |
3,80 |
2,727 |
2,03 |
|
55,3 |
9,58 |
4,17 |
2,863 |
1,96 |
|
61,9 |
9,54 |
4,53 |
2,966 |
1,86 |
|
78,5 |
9,47 |
5,25 |
3,222 |
1,68 |
|
101,8 |
9,40 |
5,95 |
3,582 |
1,53 |
|
147,5 |
9,33 |
6,65 |
4,285 |
1,39 |
|
163,5 |
9,26 |
7,33 |
4,532 |
1,25 |
|
178,5 |
9,19 |
8,01 |
4,764 |
1,14 |
|
186,7 |
9,13 |
8,67 |
4,892 |
1,05 |
|
195,4 |
9,06 |
9,33 |
5,027 |
0,97 |
|
198,8 |
9,00 |
9,98 |
5,081 |
0,90 |
|
199,8 |
8,93 |
10,61 |
5,098 |
0,84 |
|
210,5 |
8,81 |
11,86 |
5,265 |
0,74 |
|
218,5 |
8,63 |
13,67 |
5,393 |
0,63 |
|
225,5 |
8,34 |
16,52 |
5,507 |
0,51 |
|
237,5 |
8,08 |
19,20 |
5,699 |
0,42 |
|
246,5 |
7,82 |
21,70 |
5,844 |
0,36 |
Построенная на
основании данных потенциометрического титрования кривая образования комплексов Cu(II) с 1-фенил-2,3-диметилпиразолин-5-тионом
в среде 6моль/л HCI при 328К представлена на рис 1.
Из рис 1 видно, что в процессе взаимодействия
Cu(II) с 1-фенил
2,3-диметилпиразолин-5-тионом в среде 6моль/л НСI при 328К последовательно образуются четыре
комплексные формы. Оценённые величины pKi при
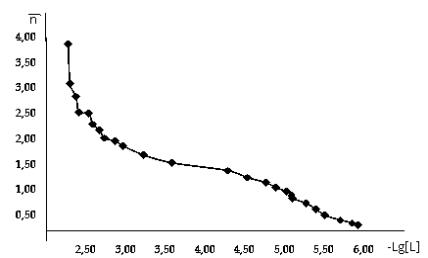
Рис.1. Кривая образовании
хлоро-1-фенил-2.3-диметилпиразолин-5-тионных
комплексов меди(II) в среде 6моль/л НСI при 328К.
полуцелых значениях ![]() оказались следующими:
pK1=5,52; pK2=3.75; pK3=2.53; pK4=2.28,
отсюда К1=3.31∙105; К2=5.62∙103;
К3=3.38∙102; К4=1,90∙102.
оказались следующими:
pK1=5,52; pK2=3.75; pK3=2.53; pK4=2.28,
отсюда К1=3.31∙105; К2=5.62∙103;
К3=3.38∙102; К4=1,90∙102.
Анализ ступенчатых констант образований
показывает, что величина К1 превосходит величину К2 в
58,9 раз, величина К2 по сравнению с величиной К3 имеет
16,63 раз большее значение, а третья константа образования превосходит четвёртую
константу в 1.78 раз. Кривая образования комплексов характеризуется тремя
участками, которые соответствуют определенным интервалам равновесных концентрации
1-фенил-2.3-диметилпиразолин-5-тиона. Первый участок охватывает интервал со
значениями –Lg[L], равными от 6.00 до 4,76, второй участок охватывает
интервал 4,76 - 3.22, а третий участок 3.22 - 2.31. Эти данные свидетельствуют
о том, что в наибольшей степени между собой отличаются величины К2 и
К3. Попытки уточнить величины экспериментально найденных констант
образований методом последовательных приближений с использованием значений всех
четырёх констант не увенчались успехом. Это, вероятно, связано с тем, что при
малых значениях разности СL
- [L] оценка четвертой константы образования сопряжена со
значительными погрешностями. Поэтому нами этим методом были уточнены три первые
константы образования, значения которых оказались следующими: К1=3.17∙105;
К2=4.85∙103; К3=4.09∙102.
После уточнения в наибольшей степени изменяется величина К1, в
наименьшей степени величина К3.
Также нами проводилось
уточнение констант образований с использованием уравнения
![]() ,
(3)
,
(3)
где β – общая
константа устойчивости; [L] - равновесная
концентрация тиопирина.
Для решения этого уравнения
была разработана программа на языке программирования Excel Borland
Delphi, операционная система Windows 7. Решение уравнения Р4у=О осуществляли по
методу половинного деления. Равновесные концентрации с 1-фенил-2,3-диметилпиразолин-5-тион
находили для всех значений ![]() от 0.1 до 4.0 с шагом
0.1. С использованием полученных данных построили кривые образования комплексов
меди(II) с 1-фенил-2,3-диметилпиразолин-5-тион (рис.2).
от 0.1 до 4.0 с шагом
0.1. С использованием полученных данных построили кривые образования комплексов
меди(II) с 1-фенил-2,3-диметилпиразолин-5-тион (рис.2).
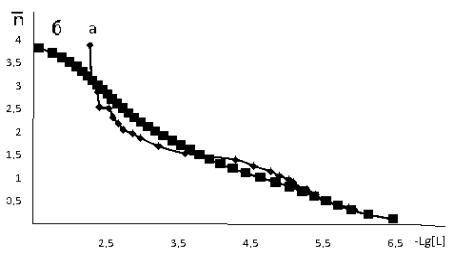
Рис.2. Кривые
образования комплексов меди(II) с
1-фенил-2,3-диме-тилпиразолин-5-тионом: а - по экспериментальным данных; б-
после обработки данных.
Из данных рис.2.
находили значения ![]() при полуцелых
значениях
при полуцелых
значениях ![]() :
: ![]() =
=![]() =5,54;
=5,54; ![]() =
=![]() =3,79;
=3,79; ![]() =
=![]() =2,73;
=2,73; ![]() =
=![]() =1,99. Найденные величины ступенчатых констант образований
хлоро–1-фе-нил-2,3-диметилпиразолин-5-тионом
комплексов меди(II) в среде 6 моль/л НСI при 328К из уточнённой кривой образования были следующими:
=1,99. Найденные величины ступенчатых констант образований
хлоро–1-фе-нил-2,3-диметилпиразолин-5-тионом
комплексов меди(II) в среде 6 моль/л НСI при 328К из уточнённой кривой образования были следующими:
![]() =3.46∙105
=3.46∙105 ![]() =6.16∙103
=6.16∙103 ![]() =5.37∙102
=5.37∙102 ![]() =9.7·101.
=9.7·101.
На рис.3 представлена
зависимость величин рКi от количества
присоединённых молекул 1-фенил-2,3-диметилпиразолин-5-тиона.
Рис.3.
Зависимость рКi=f(i) для
комплексов меди(II) с 1-фенил-2,3-диме-тилпиразолин-5-тионом.
1- неутонченные; 2 – уточнённые.
Из рис.3. видно, что с
увеличением i происходит уменьшение величин рКi, что, вероятно, связано со стерическими препятствиями
при вхождении последующих молекул с 1-фенил-2,3-диметилпиразолин-5-тион.
На
основании уточнённых значений ступенчатых констант образований рассчитаны
кривые распределения всех комплексных форм, образующихся в системе CuCI2 – 1-фенил-2,3-диметилпиразолин-5-тионом – 6 моль/л НСI при температуре 328К (рис.4).
Найденные из кривых
распределений величины максимумов
выхода комплексных форм для хлоро – 1-фенил-2,3-диметилпиразолин-5-тионом
комплексов меди(II) при 328К приведены в табл 2.
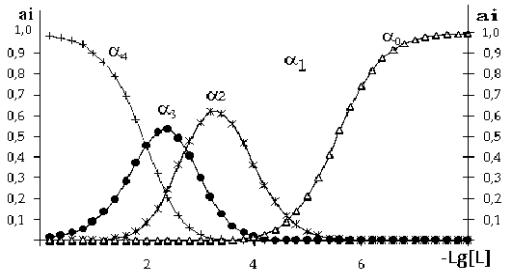
Рис.4. Кривые
распределения хлоро–1-фенил-2,3-диметилпиразолин-5-тионом
комплексов меди(II) в среде 6 моль/л НСI при 328К:
α0-[Cu(H2O)6]; α1-[CuL(H2O)5]+; α2-[CuL2(H2O)4]2+; α3-[CuL3(H2O)3]3+; α4-[CuL4(H2O)2]4+:
Таблица 2
Максимумы выхода комплексных форм меди(II) c 1-фенил-2,3-диметилпира-золин-5-тионом в среде 6 моль/л
HCI при 328К.
|
Комплексное соединение |
αimax |
-Lg[L] |
|
[CuL(H2O)5]+ |
0.78 |
4.8 |
|
[CuL2(H2O)4]2+ |
0.62 |
3.2 |
|
CuL3(H2O)3]+3 |
0.53 |
2.4 |
Из данных табл.2 видно, что с увеличением числа
координированных молекул тиопирина αimax смещается в
сторону больших значений равновесной концентрации с
1-фенил-2,3-диметилпиразолин-5-тионом.
Литературе
1. В.Н. Подчайнова, Л.Н. Симонова. – М.: Наука, 1990.-
279с.
2. ХХVI Международная Чугаевская
конференция по координационной химии ,Казань, 6-10 октября 2014 года Тезисы
докладов Казань 2014.-757с.
3.
Бикулова А.Т. Cинтез и своиства комплексов 1 – фенил – 2,3 –
диметилпиразолон – 5 – тиона с металлами / капина А.П. Медведева Е.А. Журн.
Прикладной Химии. – 1985, № 8, - c. 1831 – 1833.
4. Аминљонов О.А., Бањодуров Ю.Ф., Њасанов Ф.Н., Бекназарова Н.С.
Комплексњосилкуни мис
(II) бо 1-фенил-2,3-диметилпиразолин-5-тион дар муњити 6 моль/л НСI
њангоми 328К.
Донишгоњи миллии
Тољикистон
Раванди комплексњосилкунии миси(II) бо 1-фенил-2,3-диметилпи-разолин-5-тион
дар муњити 6моль/л НСI дар температураи 328 К омўхта шуд. Муайян карда шуд,ки миси(II) бо ин лиганд чор
шаклњои комплексї њосил мекунад. Ќиматњои константањои њар чор шакли комплексњо муайян карда шудаанд.
Калимањои калидї: мис(II)-комплексњосилкунї-1-фенил-2,3-димети-лпиразолин-5-тион-константањои устуворї - мањлул.
Amindjanov A. A., Bahodurov Y. F., Khasanov F.N.,
Beknazarova N.S.
Complexation with copper (II) 1-phenyl-2,3-dimetilpirazolin-5-tionnom
in the 6mol/l HCI at 328 k.
Tajik national Unversity
The process of
complexation of copper (II) c 1-phenyl-2,3-dimetilpirazolon-5-thione in an environment
of 6 mol / L at 328K HCI. Found that Cu (II) with the ligand forms a complex of
four forms. The values of the formation constants of the complexes formed in
the studied system.
Key words:copper(II)
- complexation - 11-phenyl-2, 3-dimetilpirazolin-5-tionnom - stability constant
- solution.