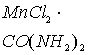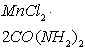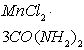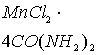Химия и химические
технологии/7. Неорганическая химия
1Еркасов Р.Ш., 2Таутова Е.Н., 3Рыскалиева Р.Г., 1Колпек
А.
Павлодарский
государственный университет им. С. Торайгырова
Кокшетауский
государственный университет им. Ш.Уалиханова
Казахский национальный
университет им. аль-Фараби
КВАНТОВО-ХИМИЧЕСКАЯ ОЦЕНКА ЭЛЕКТРОННОЙ СТРУКТУРЫ КОМПЛЕКСОВ ХЛОРИДА
МАРГАНЦА С КАРБАМИДОМ
В настоящее время наряду с традиционными
направлениями исследования координационных соединений солей марганца с
различными по природе органическими лигандами, большое внимание уделяется
изучению пространственного и электронного строения методами квантовой химии. При теоретических расчетах
квантово-химическими методами, процессы, происходящие в молекулах с участием
электронов, рассматриваются с позиций квантовой механики, единственно пригодной
для изучения процессов микромира.
Присутствие в молекулах амидов двух
потенциально реакционно-способных центра – атома кислорода карбонильной группы
и атома азота аминогруппы – позволяет им в принципе образовывать два типа
связей с молекулами донорами протонов: О…Н – Х
и N – H…X. На стабильность образующихся соединений будет
значительно влиять делокализованная π-электронная система амидов,
способная перераспределять заряд в карбонильную группу молекул [1-3]. Большая
часть имеющихся экспериментальных данных указывает на то, что протонирование
амидов кислотами или присоединение к ним ионов металлов происходит по
карбонильному кислороду.
В связи с этим интерес вызывает расчет
электронных характеристик для гетероатомов (потенциальных реакционных центров –
атомов O и N) в молекулах
карбамида исследуемых комплексов с солями марганцам, а также зависимость
электронного строения (величин эффективных зарядов, ПИ и дипольного момента) от
влияния изменения количества молекул карбамида в модельных соединениях.
В настоящей работе
представлены результаты анализа рассчитанных квантово-химическим методом РМ3
электронных и энергетических параметров комплексных соединений, образующихся
между карбамидом и хлоридом марганца.
Метод РМЗ является полуэмпирическим методом
валентного приближения, т.е. учитывает валентные электроны и атомные орбитали
(АО) валентных оболочек.
Основные электронные и энергетические
характеристики исследованных моделей соединений представлены в таблице 1.
Таблица 1
Электронные и энергетические характеристики карбамидных
комплексов хлорида марганца
Соединения
Харак-
теристики
|
|
|
|
|
|
-DfН, кДж/ моль |
1494,44 |
1460,47 |
1623,06 |
626,72 |
|
-Еtot,, эВ |
2801 |
3267 |
3752 |
4216 |
|
ПИ,
эВ |
8,90 |
7,99 |
8,87 |
8,99 |
|
m, D |
3,66 |
3,30 |
2,81 |
8,94 |
|
q (O), е.з. |
-0,373 |
-0,305 -0,534 |
-0,422 -0,386 -0,345 |
-0,415 -0,292 -0,172 -0,137 |
|
q (N1 ), е.з. |
+0,835 +0,059 |
+0,729 +0,706 -0,056 -0,018 |
+0,799 +0,697 +0,692 -0,066 +0,052 +0,028 |
-0,130 +0,652 +0,517 +0,299 -0,052 -0,044 -0,088 +0,143 |
Одним
из параметров, характеризующих электронное строение молекул, является эффективный
заряд на атомах (q).
Эффективные заряды относятся к категории величин, трудно определяемых
экспериментально. Зарядовые характеристики в использованном в данной работе
расчетном квантово-химическом методе РМ3 получены по Маликену. По формуле
Маликена заряд на атоме определяется по соответствующим коэффициентам, которые
отражают лишь формальный относительный вес атомной функции в МО. Отсюда
следует, что определяемый по Маликену заряд на атоме, не является сопоставимой
с экспериментом величиной, а некоторое вспомогательное понятие, которое можно
использовать в качественных оценках распределения заряда [1,2].
Сравнительный
анализ электронного распределения в молекулах исследованных в данной работе
соединений показывает, что наибольший полный отрицательный заряд концентрируется
на атомах кислорода карбонильной группы. Абсолютное значение этой характеристики
для всех исследованных молекул независит от числа молекул карбамида, образующих
комплекс. Самое низкое значение отрицательного заряда на атоме кислорода
карбонильной группы характерно для модельной молекулы ![]() .
.
На атомах азота аминогруппы модельных молекул координационных соединений
наблюдается концентрация положительного эффективного заряда, величина которого
заметно уменьшается по сравнению с молекулой ![]() . С
усложнением пространственной структуры моделей наблюдается не только уменьшение
по абсолютной величине положительного эффективного заряда на атоме азота, но и
концентрация отрицательного эффективного заряда одного из атомов азота
аминогруппы в молекуле карбамида, но меньшего по значению в сравнении с
отрицательным эффективным зарядом на этом атоме кислорода карбонильной группы
амида. Это связано, по-видимому, с усложнением геометрического строения
молекул, в связи с увеличением в их составе количества соединенных с центральным
атомом комплекса молекул карбамида, что в свою очередь сказывается на изменении
величин эффективных зарядов, первого потенциала ионизации и дипольного момента координационных
соединений. Изменение вышеназванных величин приводит к изменению электронной
структуры исследуемых моделей. Таким образом, сопоставление величины эффективного
заряда на атомах карбонильного кислорода и азота показывает, что она больше на
атоме кислорода во всех исследуемых случаях. Это указывает на более высокую
электронодонорную, а следовательно, и реакционную способность атома кислорода
карбонильной группы.
. С
усложнением пространственной структуры моделей наблюдается не только уменьшение
по абсолютной величине положительного эффективного заряда на атоме азота, но и
концентрация отрицательного эффективного заряда одного из атомов азота
аминогруппы в молекуле карбамида, но меньшего по значению в сравнении с
отрицательным эффективным зарядом на этом атоме кислорода карбонильной группы
амида. Это связано, по-видимому, с усложнением геометрического строения
молекул, в связи с увеличением в их составе количества соединенных с центральным
атомом комплекса молекул карбамида, что в свою очередь сказывается на изменении
величин эффективных зарядов, первого потенциала ионизации и дипольного момента координационных
соединений. Изменение вышеназванных величин приводит к изменению электронной
структуры исследуемых моделей. Таким образом, сопоставление величины эффективного
заряда на атомах карбонильного кислорода и азота показывает, что она больше на
атоме кислорода во всех исследуемых случаях. Это указывает на более высокую
электронодонорную, а следовательно, и реакционную способность атома кислорода
карбонильной группы.
Сравнение энтальпий образования исследуемых
координационных соединений карбамида с хлоридом марганца – ![]()
![]()
![]()
![]() показывает,
нижеследующее.
показывает,
нижеследующее.
Квантово-химические расчеты энтальпии
образования комплексов имеют значительные по абсолютной величине отрицательные
значения, что свидетельствуют об их высокой устойчивости.
Сравнение
устойчивости исследуемых комплексов с изменением количества молекул карбамида,
показывает, что наименьшее по абсолютной величине отрицательное значение
характерно для комплекса, имеющего в своем составе большее количество молекул
карбамида – ![]() , а наиболее устойчивым
соединение –
, а наиболее устойчивым
соединение – ![]() , -DfН, которых равна: - 626,72 кДж/ моль и
–1623,06 кДж/моль, соответственно. Координирование
еще одной молекулы карбамида к марганцу в соединении
, -DfН, которых равна: - 626,72 кДж/ моль и
–1623,06 кДж/моль, соответственно. Координирование
еще одной молекулы карбамида к марганцу в соединении ![]() приводит к незначительному снижению
стабильности по сравнению с комплексом –
приводит к незначительному снижению
стабильности по сравнению с комплексом – ![]() , затем по
мере добавления молекул карбамида наблюдается увеличение устойчивости
комплекса, с последующим резким его понижением. Изменение устойчивости исследуемых соединений объясняется
стерическими факторами и электронным влиянием различного числа гетероатомов,
входящих в соединения.
, затем по
мере добавления молекул карбамида наблюдается увеличение устойчивости
комплекса, с последующим резким его понижением. Изменение устойчивости исследуемых соединений объясняется
стерическими факторами и электронным влиянием различного числа гетероатомов,
входящих в соединения.
Расчеты потенциала ионизации (ПИ) в
использованном квантово-химическом методе проведены по теореме Купманса, согласно которой энергия
ионизации электрона из данной МО равна с обратным знаком энергии этой МО, вычисленной
по методу ССП [1]. Анализ величин ПИ показывает, что его значение для
соединения ![]() несколько
ниже, а в комплексе
несколько
ниже, а в комплексе ![]() несколько
выше, по сравнению с
несколько
выше, по сравнению с ![]() . Для исследуемых молекул рассчитаны величины дипольных
моментов, представляющих собой векторные суммы по трем направлениям: х, у
и z. Природа дипольного момента объясняется следующими
факторами: смещением центра тяжести заряда связывающих электронов к более
электроотрицательному атому; появлением гомеополярного диполя вследствие
различия в размерах атомных орбиталей, образующих связывающую молекулярную орбиталь;
асимметрией атомных орбиталей и др. Тем самым эта характеристика напрямую
связана с электронным строением рассматриваемых молекул.
. Для исследуемых молекул рассчитаны величины дипольных
моментов, представляющих собой векторные суммы по трем направлениям: х, у
и z. Природа дипольного момента объясняется следующими
факторами: смещением центра тяжести заряда связывающих электронов к более
электроотрицательному атому; появлением гомеополярного диполя вследствие
различия в размерах атомных орбиталей, образующих связывающую молекулярную орбиталь;
асимметрией атомных орбиталей и др. Тем самым эта характеристика напрямую
связана с электронным строением рассматриваемых молекул.
Анализ величин дипольных моментов
исследованных молекул показывает, что наиболее высоким дипольным моментом
обладает молекула ![]() , а наименьшим –
молекула
, а наименьшим –
молекула ![]() . Наличие дипольного
момента в нейтральных молекулах подтверждает наличие в них ранее установленного
амидного сопряжения [3,4]. Разница в значениях дипольных моментов исследованных
моделей связана также с различиями в электронной природе исследуемых
комплексов.
. Наличие дипольного
момента в нейтральных молекулах подтверждает наличие в них ранее установленного
амидного сопряжения [3,4]. Разница в значениях дипольных моментов исследованных
моделей связана также с различиями в электронной природе исследуемых
комплексов.
Для исследованных моделей рассчитаны величины полной
энергии. Для всех рассчитанных молекул наблюдается зависимость значений полной
энергии от их качественного состава и строения, что позволяет сделать вывод о
корректности расчета этой характеристики методом РМ3.
Таким образом, анализ рассчитанных квантово-химическим
методом электронных характеристик исследуемых комплексов позволяет сделать
вывод, что все они в принципе могут быть использованы для оценки реакционной
способности комплексов и взаимозависимости электронного строения и физико-химических
свойств молекул.
Литература:
1.
Берсукер И.Б.
Электронное строение и свойства координационных соединений. - Л.: Химия, 1976.
- 352 с.
2.
Radom L. Effects of alkyl groups on acidities and basicities in the gas
phase. An abinitio molecular orbital study //J.Chem. Phys. – 1975. – V.28, № 1.
– P.1-6.
3.
Кабачник М.И. Новое в
теории кислот и оснований //Успехи химии. – 1979. – Т.58, № 9. – С.1528-1547.
4.
Общая органическая
химия. Т.4. //Под ред. Д.Бартона, У.Д.Оллиса. – М.: Химия, 1983. – 728 с.
Фамилии авторов: Еркасов Р.Ш., Таутова Е.Н., Рыскалиева Р.Г., Колпек А.
Название
тезисов: КВАНТОВО-ХИМИЧЕСКАЯ ОЦЕНКА ЭЛЕКТРОННОЙ СТРУКТУРЫ КОМПЛЕКСОВ
ХЛОРИДА МАРГАНЦА С КАРБАМИДОМ
Страна: Казахстан
Количество страниц: 5
Необходимое
количество сборников: 1
Почтовый
адрес: Еркасов Р.Ш., Казахстан, г.Павлодар, Павлодарский
государственный университет им. С.Торайгырова, ул. Ломова 64, каб. 507
e – mail: erkass@mail.ru. Мобильный телефон: 87056037000, 87056137730.
Название секции: Химия и химическая технология/7.
Неорганическая химия.