Ермолаева
А.Н., Кухар Е.В., к.в.н., Балджи Ю.А. к.в.н.
Казахский
агротехнический университет им. С. Сейфуллина,
г.
Астана, Республика Казахстан
ХАРАКТЕРИСТИКА ШТАММА ASPERGILLUS FLAVUS, ИСПОЛЬЗОВАННОГО ДЛЯ ПОЛУЧЕНИЯ АНТИГЕННЫХ
ПРЕПАРАТОВ
Актуальность. Грибковые заболевания являются
важной проблемой клинической медицины и ветеринарии. Из потенциальных «болезней
будущего» микозы превратились в актуальные «болезни настоящего». Возбудители
микозов многочисленны и вызываемые ими заболевания человека и животных весьма
разнообразны. Количество видов микроскопических грибов (микромицетов) оценивается
приблизительно в 100000-200000 видов [1]. В настоящее время нет практически ни
одной страны, в которой не были бы зарегистрированы случаи микозов человека и животного. Ежегодно описывается около
1500 новых видов. В настоящее время большое значение имеют грибы рода Aspergillus [2].
Грибы рода Aspergillus
встречаются повсеместно. Обычные места их обитания – почва и гниющие растения.
Заражение происходит при вдыхании спор гриба. Род Aspergillus включает более 300 видов, однако, лишь немногие из них
патогенны для человека [3].
Аспергиллез – болезнь человека, микоз, вызываемая отдельными
видами плесневых грибов рода Aspergillus
и проявляющая себя преимущественно вовлечением системы органов дыхания в
результате аллергической реакции, выходящего за рамки этой системы с развитием диссеминации
и специфическим поражением других органов. Тяжелее всего протекает заболевание,
вызванное Aspergillus fumigatus; этот
вид выделяют более чем в 90% случаев аспергиллеза. Другие важные возбудители
аспергиллеза – Aspergillus niger и Aspergillus flavus [4]. Различные виды
аспергилл постоянно находятся в организме многих здоровых животных и людей.
Снижение резистентности организма, ухудшение условий содержания и кормления
способствует заболеванию аспергиллезом. Некоторые штаммы аспергилл обладают
способностью активно выделять токсины, вызывающие интоксикацию организма [2].
Источниками аспергилла являются
вентиляционные, душевые системы, старые подушки и книги, кондиционеры,
ингаляторы, увлажнители воздуха, почва комнатных растений, пищевые продукты,
гниющая трава и др. Регионы с высоким содержанием спор в окружающей среде – Судан
и Саудовская Аравия. В воздухе жилых помещений обычно определяются более
высокие концентрации спор аспергилл, чем на открытом воздухе. Больные сахарным
диабетом подвержены поражению аспергиллами независимо от региона. Заболевание неконтагиозное
и не передаются от человека к человеку [4].
Статистические данные последних лет
подтверждают растущую актуальность заболевания. Так, согласно данным E. M. Harman, T. Szwed, 2003 в США тяжелые формы аспергиллеза наблюдались у 5-13%
реципиентов костного мозга, 5-25% подвергнувшихся пересадке сердца или легкого,
10-20% больных лейкемией, находящихся на интенсивной химиотерапии, не менее чем
у 17% больных туберкулезом и хронической кавернозной болезнью легких [5].
Как указывает Т.Н. Лебедева, в
последнее время во всех развитых странах мира отмечается неуклонный рост
аллергических заболеваний. Показатели частоты сенсибилизации к грибам варьируют
в широких пределах: от 2% до 60% в зависимости от вида гриба и принадлежности
пациентов к группам риска развития микогенной аллергии [6]. По данным Козловой
Я.И, Васильевой Н.В рост заболеваемости аспергиллезом за последнее время. резко
возрос и в странах Европы и России. Об этом свидетельствует увеличение числа
госпитализаций больных и смертности [7]. Данные Балджи А.Ю., Майканова Б.С. в
Казахстане высокие показатели заболеваемости наблюдаются в районах
Мангыстауской и Алматинской областях. Это объясняется тем, что в этих районах
более сухой и теплый климат [8].
Известно, что приготовление
диагностикумов связано, прежде всего, с тщательной подготовкой и селекцией
штаммов микроорганизмов, из которых они будут изготовлены. Современные
биотехнологические процессы, основанные на получении конечного продукта с
использованием микробного синтеза, нуждаются в высокопродуктивных
производственных штаммах микроорганизмов. При этом от качественных характеристик
биологического объекта зависит ценность биопродукта. Штаммы
должны быть высокопродуктивными, давать высокий выход биомассы, иметь
достаточную концентрацию необходимого вещества (белков или углеводов), обладать
соответствующей антигенной активностью и специфичностью, образовывать
устойчивую гомогенную смесь в процессе ферментации. Поиск продуцентов, удовлетворяющих технологическим
требованиям и адаптированных к росту на искусственных питательных средах, исследование
их биологических свойств является одним из
основных и значимых этапов разработки биопрепаратов [9].
Целью работы является
изучение культуральных свойств штамма Asp. flavus.
Материалы и методы:
В работе использованы:
штамм гриба Aspergillus flavus №12; белковый антиген
и корпускулярный антиген Asp. flavus; вакцинный препарат ЛТФ-130.
Поверхностное культивирование гриба Asp. flavus штамма №12 проводили в чашках Петри
и пробирках на скошенном агаре при температуре 28 и 37°С в течение 3-5 суток до
завершения формирования характерных колоний. Изучение культуральных свойств
проводили с использованием макроскопических методов и микроскопии неокрашенных
и окрашенных мазков [10].
Результаты
исследований
Для идентификации и
характеристики штамма на первом этапе работы культура Aspergillus flavus была высеяна на плотные среды Сабуро. Посев осуществляли в чашки Петри и на
скошенный агар в пробирки.
При поверхностном культивировании
наблюдали большую скорость роста гриба, однородность структуры мицелия.
Достаточно заметный рост колоний начался на вторые сутки. Молодые колонии
белые, пушистые, диаметр которых к исходу вторых суток достигал до 2 мм.
Формирование характерных колоний завершается к третьим суткам. Зрелые колонии Asp. flavus
непрозрачные, оливкового цвета, плотной консистенции, пушистые, с однородной структурой.
На третьи сутки колонии оливковые, пушистые, до 4-5 мм в диаметре. Растущий край колоний выражен в виде белого пушистого
мицелия.
Характер роста гриба Asp. flavus штамма №12 на поверхности
агара Сабуро показан на рисунке 1.

Рисунок 1. Культура Aspergillus
flavus №12 на агаре Сабуро
Микроскопическое
исследование проводили на третьи сутки культивирования гриба.
Для микроскопии
плесневого гриба Asp. flavus
готовили препараты на предметных стеклах. Соскоб Asp. flavus с мицелием и спорами,
взятыми из бокового края культуры, наносили на предметное стекло. Затем
добавляли каплю дистиллированной воды и накрывали покровным стеклом. Препарат
просматривали под микроскопом при использовании объектива ×10, ×40.
В мазках обнаружены бесцветные
септированные гифы мицелия, прямые бесцветные конидиеносцы, большое количество
спор. Наблюдаемые процессы свидетельствуют об интенсивном спорообразовании.
Споры округлой формы оливкового цвета с диаметром от 2 до 4 мкм. Микроскопическая
характеристика штамма №12 Asp. flavus показана на рисунке 2.
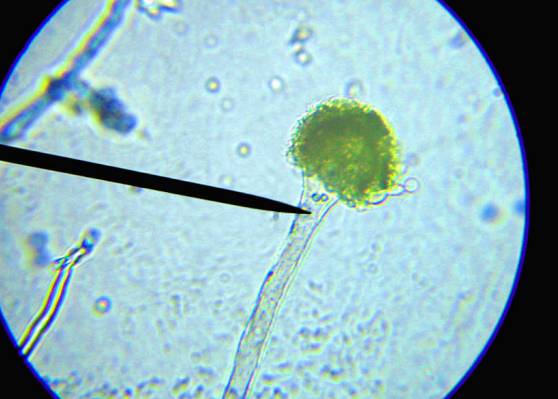
Рисунок 2 – Конидиеносцы
с филиадами на метулах Aspergillus flavus (увеличение ×400)
При культивировании гриба в пробирках на
скошенном агаре достаточно заметный рост колоний наблюдается с первых суток.
Диаметр колоний к исходу первых суток составлял 1 мм. К исходу вторых суток диаметр
колоний достигал до 3 мм. При дальнейшем наблюдении установили, что к третьим
суткам наблюдается сплошной рост пушистого мицелия по всей поверхности агара.
Культура на скошенном агаре приобрела лимонно-зеленый цвет (рисунок 3).
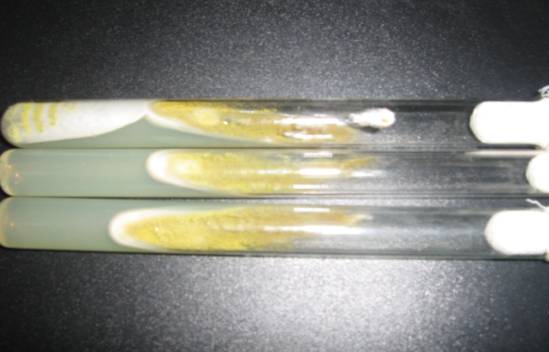

Рисунок 3 – Культуральные
свойства Aspergillus flavus штамма №12
при культивировании на
скошенном агаре Сабуро
Как видно из рисунка 3, в пробирках рост колоний
наблюдается по всей поверхности агара. Культура Aspergillus flavus на скошенном агаре лимонно-зеленого цвета. Наблюдается
интенсивное развитие спорообразования.
Следует отметить, что при поверхностном
культивировании штамма гриба нами не отмечено наличие контаминации посторонней
микрофлорой.
Выводы
Таким образом, в результате исследований
нами была охарактеризована культура Asp.
flavus. Штамм гриба Aspergillus
flavus №12 отличался наличием характерных свойств, присущих грибам этого
вида, что позволило нам использовать его в дальнейшей работе.
Использованная литература:
1. Lutz B.D., Jin
J., Rinaldi M.G., Wickes B.L. Outbreak of invasive Aspergillus infection in
surgical patients, associated with a contaminated air-handling system // Clin.
Infect. Dis.
– 2003. – Vol. 37. – P. 768-793.
2. Богомолова Т.С., Васильева Н.В., Горшкова
Г.И. Микобиота некоторых жилых помещений в г. Москве // Проблемы мед микологии.
– 1999. – Т.1, №3. – С. 41-43.
3. Петрович С.В. Микозы животных. – Москва, 1989
– С. 191.
4. Углева Е.М., Петрова М.А., Разумовская Т.С.
Возможности математического прогнозирования риска возникновения бронхиальной
астмы. – 2004. – № 2. – С. 63-68.
5. Harman E.M.,
Szwed T. Aspergillosis (2003) // http://www.emedicine.
com/med/topik174.htm.
6. Лебедева Т.Н. Возможности раннего
прогнозирования риска развития бронхиальной астмы. Дисс. … канд. мед. наук. –
ГОУВПО «Санкт-Петербургский государственный университет». – СПб, 2007. – С.171-172.
7. Козлова Я.И., Васильева Н.В. Микогенная
аллергия у жителей пораженных микромицетами. – СПб, 2008. – С.17-18
8. Балджи Ю.А., Майканов Б.С. Рекомендации по
применению фитопрепаратов и динамического электронейростимулятора при микозах и
микотоксикозах сельскохозяйственных животных и птиц. – Астана, 2006.– 11 с.
9. Альмагамбетов К.Х. Основы биотехнологии. –
Астана, 2006.– С.44-67.
10. Кашкин П.Н., Лисин В.В. Практическое
руководство по медицинской микологии. – Ленинград: Медицина, 1983. – С. 98-111.