*99500*
Химия и химические
технологии / 6. Органическая химия
Дикусар Е.А.1,
Поткин В.И.1, Козлов Н.Г.1, Степин С.Г.2,
Тлегенов Р.Т.3
1Институт физико-органической химии Национальной академии
наук Беларуси
2Витебский государственный технологический университет,
Беларусь
3Каракалпакский государственный
университет им. Бердаха, Узбекистан
(Е)-4-ЭТОКСИФЕНИЛИМИНОМЕТИЛАРИЛЫ
И ИХ ГИДРОХЛОРИДЫ
п-Фенетидин
(4-этоксианилин)
(I) приобрел особое значение как исходный материал для
получения целого ряда противолихорадочных, жаропонижающих и антиневралгических
средств, начиная с фенацетина (ацетил-п-фенетидина),
полученного еще в 1887 г. [1].
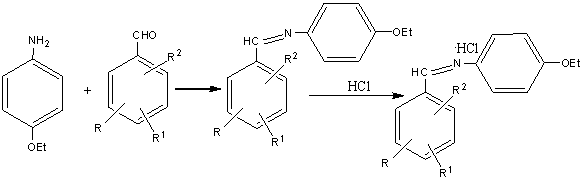
В
настоящей работе описан препаративный метод синтеза новых производных (Е)-4-этоксифенилиминометиларилов (IIIа-ц,
IVа-к, VIIа-г), полученных
конденсацией п-фенетидина
(I) с
ароматическими альдегидами (II): бензальдегидом,
анисовым и вератровым альдегидами, исходными и замещенными альдегидами
ванилинового ряда, 4,41-диформилбифенилом и
госсиполом [2,2'-ди-(1,6,7-триокси-З-метил-5-изопропил-8-нафтальдегидом].
Синтез проводили в абсолютном метаноле при температуре кипения растворителя,
выход (IIIа-ц, IVа-к, VIIа-г)
составлял 87-93%.
Взаимодействием одноосновных азометинов (IIIа-ц,
IVа-к) с газообразным хлористым водородом в абсолютном эфире
были получены соответствующие гидрохлориды 4-этоксифенилиминометиларилов (Vа-ц, VIа-к)
с выходом
89-95%. В разработанных условиях не наблюдалось побочных реакций гидролиза
боковых сложноэфирных групп соединений (Vк-ц, VIв-к).
Получить гидрохлориды двухосновных азометинов (VIIa-г) не удалось из-за их
низкой растворимости в эфире и бензоле.
Синтезированные
соединения (IIIа-ц, IVа-к, Vа-ц,
VIа-к, VIIа-г) представляют собой
устойчивые желтые или оранжевые кристаллические вещества, имеющие четкую
температуру плавления, они растворимы в
эфире, бензоле, хлороформе и ДМСО и не растворимы в воде. Гидрохлориды (Vа-ц,
VIа-к) не растворимы в неполярных апротонных растворителях, но
растворимы в спиртах, ацетоне, ДМСО и, умеренно – в воде. Это обстоятельство
делает удобным и перспективным исследование их биологической активности [2,3].
I II
IIIа-ц, IVа-к Vа-ц, VIа-к
III, V, R = R1 = R2 = H (а); R = R1 = H, R2 =
4-(HO) (б),
4-(MeO) (в); R = H, R1
= 2-(HO), R2 = 4-(HO) (г), 3-(MeO) (д); R = H,
R1 = 3-(HO), R2 =
4-(MeO) (e); R = H, R1 = 3-(MeO), R2 = 4-(HO) (ж), R2 = 4-(МеO) (з);
R = 3-(MeO), R1 =
4-(MeO), R2 = 6-(Br) (и); R = H, R1 = 3-(MeO), R2 = 4-(MeCO2) (к), 4-(EtCO2) (л), 4-(PrCO2) (м), 4-(i-PrCO2) (н), 4-(BuCO2) (o), 4-(i-BuCO2) (п), 4-[Me(CH2)8CO2]
(p), 4-[Me(CH2)11CO2] (c), 4-[Me(CH2)16CO2]
(т), 4-(C6H5CO2) (y), 4-(2,4-Cl2C6H3CO2) (ф), 4-(MeOCO2) (x), 4-(1-AdCO2)
(ц); IV, VI, R = H, R1 = 3-(EtO), R2 = 4-(HO) (a), 4-(MeO) (б),
4-(MeCO2) (в), 4-(EtCO2)
(г), 4-(PrCO2) (д), 4-(i-PrCO2) (е), 4-(BuCO2) (ж), 4-(i-BuCO2) (з), 4-(C6H5CO2)
(и), 4-(4-MeC6H4CO2) (к).
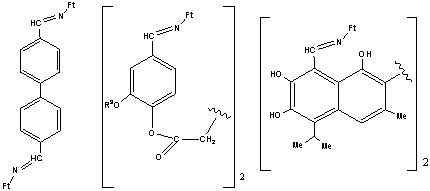
VIIa VIIб, в VIIг
VIIа-г, Ft = 4-EtOC6H4,
R3 = Me (б),
Et (в).
В ИК спектрах азометинов (IIIа-ц,
IVа-к, VIIа-г) наблюдались
следующие характеристические полосы поглощения (n,
см-1): СHаром.
–
3100-3030, 880-690; СНалиф. – 2980-2850; C=Oэфирн. – 1770-1720 (IIIк-ц, IVв-к,
VIIв,г); С=Саром. – 1610-1460; С=N – 1630-1615; C–O – 1275-1020 и отсутствовала полоса поглощения C=Oальдегид. –
1700-1680,
характерная для исходных бензальдегидов (II). В ИК спектрах гидрохлоридов оснований Шиффа (Vа-ц, VIа-к)
дополнительно присутствовали полосы поглощения: N+H
– 2750-2250; С=N+ –
1670-1650. В ИК
спектрах гидрохлоридов (Vк-ц, VIв-к)
присутствовали полосы поглощения C=Oэфирн.,
положение и интенсивность которых практически не изменились по сравнению с
исходными азометинами (IIIк-ц, IVв-к).
В ЯМР 1Н спектрах азометинов (IIIа-ц,
IVа-к, VIIа-г) присутствовали
следующие сигналы протонов фрагмента п-фенетидина (δ, м.д.): 1.2-1.7 (т, Me),
3.8-4.3 (к,
СН2), 6.7-7.4 (м, С6Н4), 8.4-8.7 (c, HC=N),
что указывает на их (Е)-конфигурацию [4];
сигналы протонов группы (МеО)
проявлялись в виде синглета в
диапазоне 3.8-4.0 м.д. (IIIв,д-ц,
IVб,
VIIб); сигналы протонов группы (EtO) – в
интервале 1.2-1.7
(т, Ме) и 3.8-4.3 (к,
СН2) (IVа-к,
VIIв).
В ЯМР 1Н спектрах гидрохлоридов (Vа-ц, VIа-к)
наблюдались сигналы протонов в области 10.0-10.2 (с, HC=N+) и
10.1-11.2 (уш. с, HN+Cl-).
В ИК и ЯМР 1Н спектрах соединений (IIIа-ц,
IVа-к, Vа-ц, VIа-к, VIIа-г)
присутствовали полосы поглощения и сигналы протонов,
подтверждающие наличие всех соответствующих структурных фрагментов
сложноэфирных групп.
(Е)-4-этоксифенилиминометиларилы
(IIIа-ц, IVа-к). Раствор 5 ммоль п-фенетидина
(I) и
5 ммоль соответствующего ароматического альдгида (II) в 40 мл абсолютного
метанола кипятили 30-45 мин. Раствор охлаждали до 0-5оС. Азометины
отфильтровывали через стеклянный пористый фильтр, остаток промывали холодным
метанолом, сушили на воздухе 6-8 ч.
Бисазометины (VIIа-г). Раствор 10 ммоль п-фенетидина (I) и 5
ммоль соответствующего двухосновного
ароматического альдгида (II) в 50 мл абсолютного
метанола кипятили 45 мин. Целевые продукты выделяли аналогично азометинам (IIIа-ц,
IVа-к).
Гидрохлориды
4-этоксифенилиминометиларилов (Vа-ц, VIа-к). Через охлажденный до 0-5оС раствор 1 ммоль
азометина (IIIа-ц, IVа-к) в 30-50 мл
абсолютного эфира барботировали сухой хлористый водород
[5] в
течении 10-15 мин. Выпавший обильный осадок целевых гидрохлоридов (Vа-ц,
VIа-к) отфильтровывали через стеклянный пористый фильтр,
остаток промывали холодным эфиром, сушили на воздухе 3-4 ч.
Литература:
1. Машковский М.Д.
Лекарственные средства. В 2 т. М.: ООО
Издательство Новая Волна, Издатель С. Б. Дивов, 2001. Т. 1. 540 с.; Т. 2. 608
с.
2. Stahl P.H., Wermuth C.G.
Handbook of Pharmaceutical Salts. Properties, Selection, and Use. Weinhem,
Germany: Wiley-VCH Verlag GmbH & Co. KgaA, 2002. 220 p.
3. Дикусар Е.А., Козлов
Н.Г., Поткин В.И., Тлегенов Р.Т., Утениязов К.У. Аминовые соли органических
кислот: синтез, свойства, биологическая активность и применение. Нукус:
«Каракалпакстан», 2009. 143 с.
4. Дайер Д.Р. Приложения
абсорбционной спектроскопии органических соединений. М.: Химия, 1970. С. 92.
5. Корякин Ю.В., Ангелов
И.И. Чистые химические вещества. М.: Химия, 1974. 408 с.