*99502*
Химия и химические
технологии / 6. Органическая химия
Дикусар Е.А., Поткин
В.И.
Институт
физико-органической химии Национальной академии наук Беларуси
(Е)-2-МЕТОКСИ-6-(R-ИМИНО)МЕТИЛФЕНОЛЫ
И
2-МЕТОКСИ-6-(R-АМИНО)МЕТИЛФЕНОЛЫ
Необходимость
борьбы с вновь возникающими резистентными штаммами патогенных микроорганизмов
постоянно стимулирует расширение исследований по синтезу новых биоцидных
препаратов для обновления их ассортимента [1].
Использование
сложноэфирной и азометиновой связи в качестве крепежного строительного элемента
(или линкера) для ковалентного присоединения к альдегидам ванилинового
ряда различных функциональных и
фармакофорных групп, может служить примером такого молекулярного дизайна [2].
Ранее мы сообщали о синтезе азометинов – производных
4-гидрокси-3-метокси(этокси)бензальдегидов, обладающих высокой биологической
активностью [3,4].
Нами
разработан препаративный метод синтеза гидроксилсодержащих азометинов (IIIа-я),
полученных конденсацией 2-гидрокси-3-метоксибензальдегида
(орто-ванилина)
(I) с алифатическими, циклоалифатическими и ароматическими
аминами (IIа-я) в абсолютном метаноле при температуре кипения
растворителя. Выход соединений (IIIа-я) составлял 80-87%.
Было изучено восстановление гидроксилсодержащих азометинов
(IIIа-я) триацетилоксиборгидридом натрия Na[BH(OAc)3]
в эфире при температуре 20-25oC. Восстановление
азометинов (IIIа-я) в
соответствующие гидроксилсодержащие амины (IVа-я) завершалось за 10-12 ч.
Выход гидроксилсодержащих аминов (IVа-я) был практически количественным и составлял
92-94%. В условиях восстановления [5], которое протекало в
специально подобранном режиме щадящего температурного и умеренного кислотного
воздействия, не наблюдалось побочных реакций восстановления или гидролиза боковых
сложноэфирных групп у соединений (IVг-ж, щ, ы).
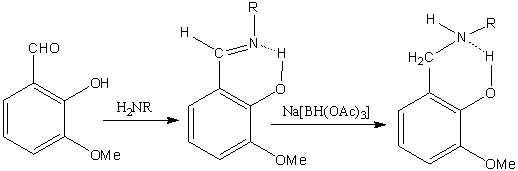
I IIа-ю IIIа-ю IVа-ю
II-IV, R
= н-C18H37 (а), цикло-С6H11 (б), СH(1-Ad)Me
(в), CH2CO2Me
(г), L-CH(CHMe2)CO2Me
(д), L-CH(CHCH2Me2)CO2Me (e), L-CH(CHMeEt)CO2Me
(ж), C6H5 (з),
4-MeC6H4 (и), 2-бифенил (к), 4-бифенил (л), 1-нафтил
(м), 2-нафтил (н), 2,6-Cl2C6H3
(о), 3-BrC6H4 (п), 4-BrC6H4 (р), 4-JC6H4 (с), 1-бром-2-нафтил
(т), 2-гидроксифенил (у), 4-феноксифенил (ф), 4-MeC(O)C6H4 (х), 4-EtC(O)C6H4 (ц), 3-HO2CC6H4 (ч), 4-HO2CC6H4 (ш), 4-EtO2CC6H4 (щ), 4-BuO2CC6H4 (ы),
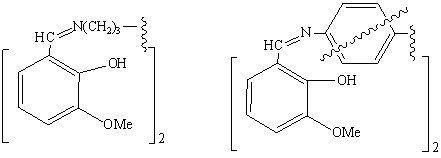
IIIэ
IIIю, я
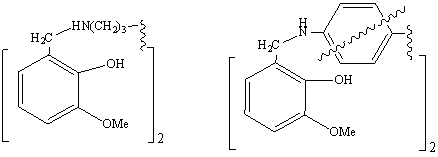
IVэ
IVю,
я
(IIIэ,
IVэ) – производные 1,6-гексаметилендиамина,
(IIIю, я, IVю,
я) –
1,3-и 1,4-фенилендамина
Полученные
соединения (IIIа-я, IVа-я) представляют собой
кристаллические или аморфные стекловидные вещества, растворимые в эфире,
бензоле, хлороформе, диметилформамиде, диметилсульфоксиде и не растворимые в
воде. Строение соединений (IIIа-я, IVа-я)
доказано данными элементного анализа и определения молекулярной массы.
В
ИК спектрах соединений (IIIа-я, IVа-я)
наблюдались следующие характеристические полосы поглощения (ν, см-1):
СНаром – 3080±5, 3060±5,
3010±5; СНалкил – 2950±5, 2920±5, 2850±5; C=O
(IIIг-ж, х-ы, IVг-ж,
х-ы) – 1685±25; С=Саром – 1585±5, 1470±5, 1445±5; С–О – 1275±5,
1255±5, 1085±5, 970±5; С–Наром – 885±5, 745±5, 715±5; в спектрах азометинов (IIIа-я)
С=N – 1630±15; в спектрах
аминов (IVа-я) NH – 3410±5.
В
спектрах ЯМР1Н соединений (IIIа-я, IVа-я)
присутствовали следующие характерные сигналы протонов, подтверждающие их
строение (δ, м.д.): 3.9±0.2 c (3H, MeO), 6.8–7.1 м
(3H, С6Н3), 13.5±0.2
c (1H, OH); у азометинов (IIIа-я)
– 8.6±0.1
c (1H, НC=N),
что характерно для азометинов (Е)-конфигурации
[6]; у аминов (IVа-я) – 4.3±0.1
c (2Н, СН2) и 6.2±0.4
уш. с (1H, NH). В отличие от производных
4-гидрокси-3-метоксибензальдегидов, у которых фенольные протоны проявляется в
области 5.4±0.4 уш. c (1H,
OH) [3,4],
в соединениях (IIIа-я, IVа-я) сигналы фенольных
протонов значительно смещены в сторону более слабого поля за счет образования
внутримолекулярных водородных связей [7].
В
спектрах ИК и ЯМР 1Н синтезированых (Е)-2-метокси-6-(R-имино)метилфенолов (IIIа-я)
и 2-метокси-6-(R-амино)метилфенолов (IVа-я) присутствуют
характерные полосы поглощения и сигналы протонов, подтверждающие наличие
соответствующих структурных фрагментов (R).
(Е)-2-Метокси-6-(R-имино)метилфенолы (IIIа-я).
Раствор
5 ммоль 2-гидрокси-3-метоксибензальдегида (I) и 5 ммоль
соответствующего одноосновного амина (IIа-я) в 40 мл абсолютного
метанола кипятили 30-45 мин. Раствор охлаждали до 0-5оС.
Кристаллические азометины фильтровали через стеклянный пористый фильтр, промывали
холодным метанолом, сушили на воздухе 6-8 ч. Стекловидные азометины отделяли
декантацией, окончательную очистку проводили с помощью колоночной хроматографии
на нейтральном оксиде алюминия, 40-100 мкм, II степени активности по
Брокману. Элюент – дихлорметан.
2-Метокси-6-(R-амино)метилфенолы (IVа-я). Раствор 5 ммоль
азометина (IIIа-я), 10 ммоль NaBH4, 30 ммоль ледяной
уксусной кислоты в 50 мл абсолютного эфира оставляли на 18-20 ч при 20-25oC.
Раствор промывали водой и 5%-ным раствором NaHCO3, растворитель удаляли в
вакууме. Остаток очищали перекристаллизацией из смеси бензола с гексаном или
колоночной хроматографией на силикагеле (100-160 мкм, элюент – бензол).
Литература:
1.
Trivedi S.D., Kubawat H.T., Parekh H.H. // J. Indian
Chem. Soc. 2002. №
3. P. 282.
2. Южик Л.И., Антоновская
Л.И., Белясова Н.А., Басалаева Л.И., Тарасевич В.А. // Химические реактивы,
реагенты и процессы малотоннажной химии: материалы «XXII Международной
научно-технической конференции (Реактив-2009)». Уфа, 23-25 ноября 2009 г. Уфа:
Реактив, 2009. С. 87-88.
3. Дикусар Е.А. // ЖОХ.
2008. Т. 78. Вып. 4. С. 642.
4. Дикусар Е.А., Козлов
Н.Г., Поткин В.И. // ЖОХ. 2008. Т. 78. Вып. 6. С. 969.
5. Esteves-Souza A.,
Echevarria A., Sant’Anna C. M.R. // Quim. Nova. 2004. Vol. 27. C. 72.
6. Дайер Д.Р. Приложения
абсорбционной спектроскопии органических соединений. М.: Химия, 1970. С. 92.
7. Desiraju G.R., Steiner T. The Weak Hydrogen Bond in Structural
Chemistry and Biology. Oxford University Press
(U.S.), 2001. 480 p.