*99649*
К.т.н., доцент Сарбаева Г.Т., к.х.н. Сарбаева K.Т.
Международный -казахско-турецкий университет
им.Х.А.Ясави, Казахстан
ЭЛЕКТРОХИМИЧЕСКИЙ СИНТЕЗ ХЛОРИДА ЖЕЛЕЗА (III)
В последние годы общее состояние окружающей среды, в том
числе качество воды с связи влиянием деятельности человека намного ухудшилось.
Основная причина
загрязнения водных бассейнов – сброс в водоемы неочищенных или недостаточно
очищенных сточных вод промышленными предприятиями, коммунальным и сельским
хозяйствами.
Очистка сточных вод – это важный процесс в системе охраны
водоемов от загрязнения. Методы очистки сточных вод подразделяются на
механические, биологические, химические и электрохимические. Эти методы очистки
сточных вод (кроме электрохимического) широко применялись в 90-е годы [1].
При химической очистке сточных вод самыми распространенными
и эффективными методами являются нейтрализация и коагуляция. В процессе
коагуляции в качестве коагулянтов применяют хлориды и сульфаты алюминия или железа. Производство коагулянтов в нашей Республике из-за сложности
технологии в промышленных условиях не производится. Поэтому нами было
исследовано влияние различных факторов на электрохимическое поведение железных
электродов промышленным трехфазным переменным током в растворе соляной кислоты.
Предложенный
способ гораздо легче осуществляется и позволяет упростить и интенсифицировать процесс получения солей
железа и алюминия. Кроме того, электрохимические методы позволяют получать экологически чистые вещества. Следовательно,
применение промышленного переменного
тока в различных водных растворах с целью получения важнейших соединений
металлов является весьма актуальным [2].
Несмотря на то, что стандартные электродные потенциалы
железа имеет положительное значение (Е = +0,77 B), образовавшееся
при атмосферных условиях оксидная пленка защищает металл от растворения в воде,
однако в кислотах, например в соляной кислоте железо значительно хорошо
растворяется:
Fe + 3HCl ® FeCl3 + H2 (1)
Fe – 3e ® Fe3+ (2)
Основным процессом при анодном окислении железа в солянокислом растворе является образование на поверхности
металла оксидной пленки.
В
работе [3] показано, что в процесс
депассивации определенных участков металла участвуют хлорид-ионы. Ионы хлора из
поверхности металла путем адсорбции расщепляют пассивирующий кислород, и в
результате скорость процесса растворения увеличивается. Однако, через некоторое
время во время перехода соединения железа (II) на железо (III), наблюдается
пассивация металла:
Fe2+
-e ® Fe3+ E0=+0.77
B (3)
Как показали предварительные опыты в растворе соляной
кислоты при поляризации железных электродов промышленным трехфазным переменным
током частотой 50 Гц происходит их интенсивное растворение с образованием
хлорида железа (III). На электрохимическое
растворение железных электродов было исследовано влияние плотности тока,
концентрации электролита, продолжительности электролиза и температура
электролита. Экспериментальные опыты проводились в электролизере обьемом
300-400 мл, с неразделенными электродными пространствами и без перемешивания. В
качестве материала электродов были использованы железные пластинки, электролит
– водный раствор соляной кислоты (50 г/л). Источником трехфазного переменного
тока служило специальное оборудование. Выход по току (ВТ) растворения железа находили по убыли масс электродов
до и после электролиза.
При поляризации переменным током в анодном
полупериоде на железных электродах наряду с (1) и (2) реакциями протекают
следующие реакции:
Fe + 3H2O ® Fe2O3
+6H+ (4)
2H2O – 4e ® O2 +4H+ (5)
а в катодном полупериоде происходит восстановление ионов водорода:
2Н+ + 2е ® Н2
(6)
Результаты исследований показывают, что в оптимальных условиях в анодном
полупериоде на железном электроде в основном протекает (2) реакция, а в
катодном полупериоде (6) реакция.
Нужно
отметить, что образование оксида железа в виде пленки на поверхности электрода
термодинамически вполне вероятно. Образовавшееся соединение может активно
принимать участие в окислительно-восстановительных реакциях.
При
поляризации железных электродов промышленным трехфазным переменным током в
сточной воде наблюдается формирование гидроксида железа (III). Это соединение образуется в виде коллоидного осадка и
занимает весь обьем электролита. А в растворе соляной кислоты железные
электроды интенсивно растворяются в виде ионов Fe3+. Если
этот процесс будет протекать в загрязненной сточной воде, то железные электроды
по (2) реакции значительно растворяются. Образовавшиеся ионы Fe3+ в ходе
электролиза взаимодействуя с ОН- -ионами образуют аморфное
соединение коричнего цвета Fe(ОН)3,
а в катодном полупериоде на поверхности железных электродов протекает реакция
выделения газообразного водорода:
2Н2О + 2е ® Н2+2ОН-
(7)
Fe3+
+3OH- ® Fe(OH)3 (8)
Таким образом, в данной работе впервые было установлена возможность очистки
сточных вод при поляризации железных электродов трехфазным переменным током.
Механизм очистки воды заключается в том, что ионы многовалентных металлов в
результате гидролиза присоединяя к себе загрязняющие компоненты выпадают в
осадок. В качестве электролита была использована сточная канализационная вода,
поэтому напряжение в электрохимической цепи высокое следовательно, через цепь
проходит очень малое количество электричества. Несмотря на это во время
электролиза выпадает Fe(OH)3.
Коллоидная частица образованного осадка гидроксида железа (III) при низких плотностях тока и рН=7,0-7,5 подвергается к
полимеризации и приобретает отрицательный заряд (гранула): {[mҒе(OH)3]nҒеO(OH)2-(n-x)H+}-
В результате протеканиям (6)
реакции при электроочистке повышается
рН воды. С повышением рН раствора золь гидроксида железа имеет
положительный заряд превращается в микрохлопья. Отрицательно заряженные примеси
находивщиеся в воде соединяясь к коллоидным частицам укрупняются и выпадают в
осадок. В результате осуществляется
очистка воды.
В настоящее время для очистки
воды в качестве коагулянта требуется очень большое количество хлорида и
сульфата железа, поэтому разработка технологий синтеза важнейших соединений
путем электрохимического растворения является одной из актуальных задач и требует всестороннего исследования.
Предложенный метод получения
хлорида железа (ІІІ) включает электрохимическое растворение железных
электродов в солянокислом растворе при поляризации трехфазным переменным током
промышленной частоты, плотности тока 0-2500 А/м2 и концентрации
соляной кислоты 50-250 г/л.
В интервале указанных плотностях тока ВТ растворения железа резко повышается (рис.1). Это
обьясняется тем, что при
высоких плотностях тока железные электроды начинают химически растворяться и
потенциал электрода смещается в положительную сторону.
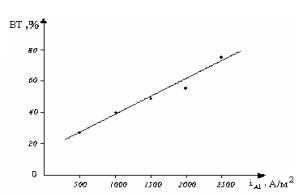
Рис.1. Влияние плотности промышленного трехфазного
переменного тока на выход по току растворения железа (СHCl=50 г/л; τ =0,5 час; t=200C)
При повышении концентрации НСl до 150-250 г/л на электродах интенсивно протекают
электродные процессы, при этом ВТ превышает 100%. Это можно обьяснить активным
действием хлорид-ионов на электрохимическое растворение железа. После
поляризации железных электродов переменным током в течение 30 минут, железо далее продолжает растворяться химически. По
видимому, в катодном полупериоде постепенно восстанавливается всегда
присутствующий оксидный слой железа. Железа без оксидной пленки химически
растворяется как электроотрицательный металл (рис.2).
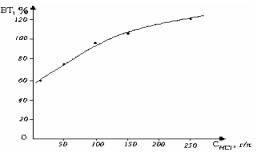
Рис. 2. Влияние концентрации соляной кислоты на выход
по току растворения железа (і =
2500 А/м2, τ =0,5 час,
t=200C)
Повышение температуры электролита незначительно влияет на ВТ растворения железа. Влияние продолжительности
электролиза на ВТ
ионов железа (III)
изучали при условиях: плотность тока – 2500 А/м2, концентрация
соляной кислоты – 50 г/л. С повышением продолжительности электролиза до
0,75-1,5 час происходит увеличение выхода по току до 150 %, что, по-видимому
связано с активным состоянием железных электродов в ходе электролиза (рис.3).
Как известно, без оксидной пленки металл может дополнительно химически
растворятся.
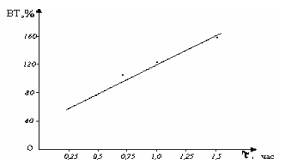
Рис.3. Влияние продолжительности электролиза на выход
по току растворения железа (і=
2500 А/м2, СHCl= 50г/л, τ =0,5 час)
Таким образом, на
основании исследования электрохимического поведения железных электродов
установлены
условия
синтеза хлорида железа (III). Продукт электролиза может применяться в качестве
коагулянта при очистке сточных вод. Результаты исследований при поляризации
трехфазным переменным током дают возможность разработать упрощенные
технологические схемы получения солей, гидроксидов и оксидов многих других
металлов.
Литература:
1. Проскуряев В.А., Шмидт Л.И. Очистка
сточных вод в химической промышленности. Л.: Химия, 1977.
2. Баешов А.Б., Баешова А.К., Сарбаева Г.Т. и др.
Инновационный патент РК № 20681 от 26.06.2007. Способ
получения хлорида железа (ІІ). Опубл. в бюлл № 1, 2009
3. Дунаев Ю.Д. Нерастворимые аноды из сплавов на основе
свинца. Алма-Ата, Наука, 1979. С.315