*99004*
Хімія і хімічні
технології / 5. Фундаментальні проблеми
створення нових матеріалів і технологій
К.т.н.
Діхтяренко М.Г.
Черкаський
державний технологічний університет, Україна
Релаксаційна здатність рідких продуктів електроактивації води
Під електрохімічною активацією
водних систем розуміють процес переходу їх в метастабільний стан, зумовлений
структурно-енергетичними і електрохімічними змінами в електричному полі.
Внаслідок переходу в метастабільний стан, розчини проявляють аномальні
властивості під час фізико-хімічних перетворень і здатні змінити властивості
інших рідин та твердих речовин. Проте, ця здатність зберігається лише протягом
періоду повільної стадії релаксації рідини. Для кожного рідкого середовища, що
піддавався електроактивації, є свій максимальний рівень окислювального чи
відновлювального стану. Електрохімічна релаксація – це процес повернення
активованого середовища в стан стійкої термодинамічної рівноваги. Цей процес є
незворотнім і тому, внаслідок закону зростання ентропії, супроводжується
переходом більшої частини електричної потенційної енергії в тепло, так званої
дисипації енергії. В процесі електрохімічної релаксації середовище проходить
ряд псевдостійких станів, які характеризуються значеннями окислення і
відновлення, на шляху до досягнення стану стійкої термодинамічної рівноваги.
Протягом цього періоду електрохімічноактивоване середовище втрачає активність і
знижує свою каталітичну здатність для деяких хімічних і біологічних процесів.
Як всяке нерівноважне явище, електрохімічна релаксація середовища не
визначається одними тільки термодинамічними характеристиками системи
(наприклад, тиском, температурою і так далі), а істотно залежить від її
мікроскопічних характеристик, зокрема від параметрів, що характеризують
взаємодію між активними частинками, якими насичені рідкі продукти
електроактивації. Такими параметрами є час вільного пробігу частинок і довжина
їх вільного пробігу. Це проміжок часу і відстань між моментами і місцями двох
послідовних елементарних зіткнень електронів, іонів, атомів молекул. Оскільки
ці мікроскопічні характеристики украй малі, в порівнянні з розмірами системи,
то встановлення електричної рівноваги відбувається у два етапи. На першому етапі рівновага встановлюється лише в малих частинах
системи. Ці частини, будучи мікроскопічно малими, все ж таки містять безліч
молекул, що взаємодіють з елементарними збудженнями, що знаходяться в їх
оточенні. Цьому процесу відповідає стадія швидкої електрохімічною релаксації.
На другому етапі відбуваються повільні процеси електрохімічної релаксації, в
результаті яких вирівнюються окислювально-відновні потенціали всіх частин
системи. Повільні процеси пов'язані з дуже великим числом послідовних зіткнень
частинок між собою. Їх час релаксації пропорційний розмірам системи (об'єму середовища)
і називається часом повільної стадії релаксації. Після закінчення цього часу
рідина повертається в стан близький до початкового, тобто набуває своїх
первинних властивостей. Тому, щоб використовувати активуючу здатність
обробленої рідини, необхідно протягом часу, рівному або меншому часу стадії
повільної електрохімічної релаксації, ввести в неї речовини, що підлягають
активації, і перемішати їх з рідиною. Час перемішування визначається моментом
стабілізації іоннообмінних процесів, що протікають між іонами і молекулами
рідини розчинених і введених в неї речовин.
Як було показано в роботах [1-4], швидкість релаксації фізико-хімічних властивостей електроактивованих водних систем залежить від умов енергообміну з навколишнім середовищем, тобто від об’єму активованого розчину і площі розділу фаз. Тому, важливим завданням є дослідження цих процесів в більш широкому діапазоні значень рН.
У роботі досліджувались проби аноліту (рН=1,33-7,17) і католіту
(рН=9,00-12,30), одержані шляхом електролізу водопровідної (питної) води (ГОСТ 18 963-73.
"Вода питьевая"), яка попередньо відстоювалась до отримання стабільних
значень рН. Процес електролізу здійснювався в
двохкамерному лабораторному електролізері, розділеному діафрагмою на дві
частини [5]. Помилка досліду складає від 0,5 до 1,5%.
Для дослідження впливу часу активації на швидкість
релаксації рН активованих середовищ проби католіту й аноліту залишались у
відкритих посудинах на 1 добу. Об'єм рідини в кожній посудині складав 500 мл,
площа контакту з повітрям 100 см2. Через добу проводилось повторне
вимірювання рН досліджуваних проб.
У роботі розраховувалась абсолютна зміна рН активованих середовищ
католіту й аноліту. Результати обробки експериментальних даних представлені на
рис. 1 і 2.
Аналіз наведених даних показує, що швидкість релаксації
активованих середовищ залежить від рН і часу активації. В усіх зразках католіту
(Рис.1) величина абсолютної зміни рН Δ становить 0,9 ‑ 1,66, що
свідчить про швидку релаксацію його фізико-хімічних властивостей.
Зразки аноліту з рН = 6,08 ‑ 7,40 (Рис. 2) мають
досить високу величину абсолютної зміни рН (Δ = 0,9 ‑ 1,3), а зразки
з рН = 1,33 ‑ 5,60 ‑ набагато меншу (Δ = 0,11 ‑
1,19). Отже, релаксація зразків аноліту з рН = 1,33 ‑ 5,60 відбувається
повільніше. Це позитивний фактор для використання активованих середовищ із
вказаним інтервалом значень рН у технологічних процесах.
Важливим результатом дослідження є те, що визначені
порогові значення рН аноліту і католіту, які розділяють на шкалі рН розчини із
стабільними властивостями, і розчини з "перехідними" властивостями.
Для аноліту це рН≈6,0, для католіту межа не така різка і знаходиться в
діапазоні рН=8,0-9,0.
Слід зазначити, що чим нижчий рН отриманого при електролізі
аноліту (або вищий рН католіту), тим більше електричної енергії необхідно
витратити на його отримання, а відповідно економічні витрати такого процесу
будуть зростати. Тому, в кожному конкретному випадку, для кожного
технологічного процесу необхідно зважено підходити до вибору параметрів
активації.
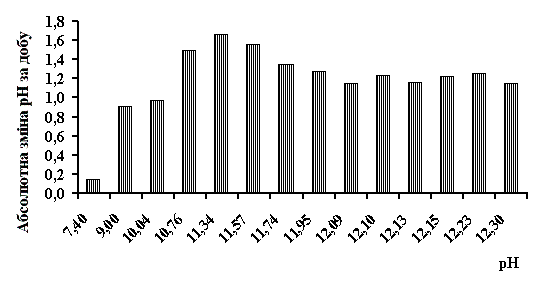
Рис. 1. Абсолютна
зміна рН католіту за добу зберігання
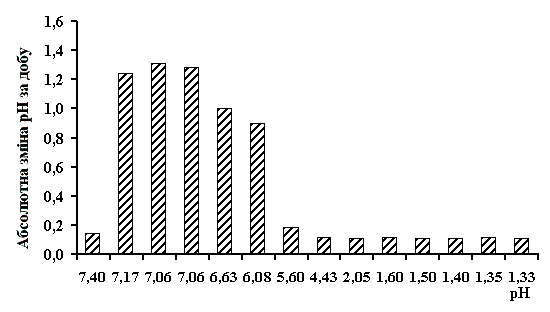
Рис. 2. Абсолютна
зміна рН аноліту за добу зберігання
Висновки
1. Швидкість релаксації активованих середовищ
залежить від рН і часу активації цих середовищ.
2.
Католіт, як один із рідких продуктів електроактивації води, піддається більш
швидкій релаксації фізико-хімічних властивостей, у порівнянні з анолітом, що є
позитивним фактором для його використання у технологічних процесах.
3. Визначені порогові значення рН рідких продуктів
електроактивації. Для аноліту це значення рівне рН≈6,0, для католіту межа
не така різка і знаходиться в діапазоні рН=8,0-9,0.
Література
1. Рогов В.М. Электрохимическая технология
изменения свойств воды. / В.М. Рогов, В.А. Филипчук – Львов: Высшая школа. Издательство при
Львовском университете, 1989. – 128 с.
2. Романенко Н.Г. Интенсификация процессов
отделки текстильных материалов путём использования электроактивированной воды /
Н.Г. Романенко, Н.А.Беляева //
Вестник ХГТУ. ‑ 2001. ‑ № 4(1). ‑ С. 334 ‑ 338.
3. Прилуцкий В.И. Электрохимически
активированная вода: аномальные свойства, механизм биологического действия /
В.И. Прилуцкий, В.М. Бахир – М.:
Наука, 1995. – 312 с.
4. Романенко Н.Г. Оптимизация условий
проведения электролизного разделения воды с целью получения продуктов,
интенсифицирующих процессы отделки текстильных материалов / Н.Г. Романенко // Вісник
Черкаського інженерно-технологічного інституту. – 2000. – №4. – С. 93 – 97.
5. Романенко Н.Г. Физико-химические основы применения
электроактивированных водных систем в технологиях отделки текстильных
материалов: дис. … доктора техн. наук : 05.19.03 / Романенко Наталия Григорьевна. –
Херсон, 2003. – 374 с.