Биологические науки/9.Биохимия и биофизика
К.х.н. Мосин О.В1.,
докт. наук Игнатов И.И2.
1Московский государственный университет прикладной биотехнологии, Москва, Талалихина 33, 109316
2Научно-исследовательский центр медицинской биофизики, София,
Коперника 32, 1111
Биологическое воздействие дейтерия на клетки различных
микроорганизмов
Одним
из интереснейших биологических феноменов является способность микроорганизмов расти в тяжеловодородных средах, в которых все атомы водорода замещены на
дейтерий [1], хотя содержание в
природе этого изотопа составляет лишь 0,015
ат.%.
В природных водах соотношение между D2O и Н2O составляет 1:5700 (в предположении,
что весь дейтерий находится в виде D2O). В смесях D2O с Н2O с большой скоростью происходит изотопный
обмен с образованием HDO: Н2O + D2O = 2HDO. Поэтому дейтерий при малом содержании
присутствует в воде в форме НDO, а при высоком – в форме D2O.
Химическое
строение молекулы D2O аналогично строению Н2O, с очень
малым различием в значениях длин водородных связей и углов между ними;
молекулярная масса D2O на 10% превышает массу Н2O.
Разница молекулярных масс определяет изотопные эффекты, которые для пары H/D
могут быть достаточно большими. В результате тяжелая вода по своим
физико-химическим свойствам отличается от обычной воды (таблица): D2O
кипит при 101,44 0С, замерзает при 3,82 0С, имеет
плотность при 20 0С 1,105 г/см3, причём максимум
плотности приходится не на 4 0С, как у обычной воды, а на 11,2 0С
(1,106 г/см3). Химические реакции в D2O протекают с медленной скоростью, чем в Н2O, она слабее ионизирована, чем Н2O, константа диссоциации D2O меньше таковой для Н2О,
растворимость органических и неорганических веществ в D2O, как правило ниже чем в Н2O, водородные связи с участием дейтерия несколько прочнее
обычных, подвижность иона D3O+ на 28,5% ниже Н3O+, а ОD- – на 39,8% ниже ОН- [2].
Таблица
Физические
свойства Н2О и D2O
|
Физические
свойства |
H2O |
D2O |
|
Молекулярная масса (а.е.м) |
18,0153 |
20,0276 |
|
Плотность при 20 0C (г/см3) |
0,9982 |
1,1053 |
|
Температура
максимальной плотности, °C |
3,98 |
11,24 |
|
Температура
замерзания при 1 атм, °C |
0 |
3,82 |
|
Температура
кипения при 1 атм, °C |
101,44 |
101,44 |
|
Давление пара
при 100 °C, мм рт. ст. |
721,60 |
760,00 |
|
Вязкость при
20 °C, сантипуаз |
1,247 |
1,002 |
Систематическое
изучение воздействия D2О на клетки животных и растений
в РФ начато сравнительно недавно [3]. Эксперименты по выращиванию клеток
различных организмов в D2O показали токсическое
воздействие на организм; высокие концентрации D2O приводят к замедлению метаболизма, ингибированию митоза в стадии
профазы и даже в некоторых случаях способны вызывать соматические мутации [4]. D2O действует отрицательно на
жизненные функции различных организмов; это происходит даже при использовании
обычной природной воды с повышенным содержанием D2O или HDO [5].
Несмотря
на биостатический эффект, оказываемый D2O на клетки, некоторые бактерии
способны выдерживать 90% D2О, в то время как растительные
клетки могут нормально развиваться при концентрациях 50–75% D2О, а клетки животных не более 35% D2О [6]. Понижение
содержания дейтерия в воде на 15–20% ниже физиологического уровня стимулирует жизненные
процессы.
Адаптация
к D2O интересна не только с научной точки зрения, но она также позволяет
получать уникальный дейтерированный биологический материал для решения задач
молекулярной организации клетки методом ЯМР-спектроскопии [7]. Дейтерированные
клетки различных микроорганизмов, адаптированных к максимальным концентрациям D2O в ростовых средах (95–98 ат.% D) являются удобными объектами для изучения структуры и
конформации дейтерированных макромолекул (протеины, нуклеиновые кислоты). В процессе роста в D2O в
клетках синтезируются молекулы протеинов и ДНК, атомы водорода в углеродных
скелетах которых почти полностью замещены на дейтерий. Такие дейтерированные макромолекулы
претерпевают структурно-конформационные изменения, необходимые для их
функционирования в D2O.
Мы
исследовали изотопные эффекты дейтерия в прокариотических и эукариотических
клетках различных таксономических групп микроорганизмов, реализующих метилотрофный,
хемогетеротрофный, фотоорганотрофный и биосинтетический пути ассимиляции
субстратов (облигантые и факультативные метилотрофные бактерии Methylobacillus flagellatum и Brevibacterium methylicum, хемогетеротрофные бактерии Bacillus subtilis,
хемоорганогетеротрофные галобактерии Halobacterium halobium, синезеленые водоросли Chlorella vulgaris)
методами 1Н-ЯМР-, ИК- и масс спектрометрии. Для адаптации клеток к D2O использовали
метод ступенчатой адаптации за счет рассева исходных клеток на твердые (2%-ный
агар) питательные среды при ступенчатом увеличении градиента концентрации D2O
(от 0; 24,5; 49,0; 73,5 до 98% D2O) и последующей селекции
устойчивых к D2O клеток. Выросшие на средах с низким градиентом
концентрации D2О клетки переносили на среды с большим градиентом
концентрации, вплоть до 98% D2О. В результате на максимально
дейтерированных средах с 98% D2О получены адаптированные к D2О
клетки, весь биологический материал которых вместо водорода содержит дейтерий. Уровень выживаемости клеток на
98% D2О составил не более 40%.
Проведенные
нами исследования свидетельствуют, что эффекты, наблюдаемые при адаптации
клетки к D2O носят комплексный многофакторный характер и связаны с изменениями
морфологических, цитологических и физиологических параметров – величины лаг-периода, времени клеточной генерации, выходов биомассы,
соотношения синтезируемых аминокислот, белков, нуклеозидов, углеводов и жирных
кислот при росте в D2O, а также с уровнем эволюционной организации исследуемого объекта. Способность к адаптации к D2O у
разных микроорганизмов различная и может варьировать в пределах одной
таксономической группы. Из этого можно заключить, что адаптация к D2O
определяется как таксономической принадлежностью микрооорганизмов, так и
особенностями их метаболизма, функционированием различных путей ассимиляции
углеродных субстратов, а также эволюционной нишей, которую занимает исследуемый
объект. При этом, чем ниже уровень эволюционного развития организма, тем лучше
он приспосабливается к присутствию дейтерия в среде. Общей особенностью
изученных микроорганизмов при росте в D2О является пропорциональное
увеличение продолжительности лаг-периода и времени клеточной генерации при
уменьшении выходов микробной биомассы. Присутствие дейтерия вызывает
физиологические, морфологические и цитологические изменения в клетках
микроорганизмов, что в конечном итоге приводит к формированию в D2O
крупных атипичных клеток, состоящих из плотно упакованных мембран, наподобие
мезосом, имеющих в 2–3 раза более толстую клеточную стенку [8], чем протонированные
клетки с неравномерным распределением ДНК (рис. 1). Также при адаптации к D2О
немаловажную роль играет состав ростовой среды и соотношения основных клеточных
метаболитов. Отмечено, что адаптация к D2О проходит легче при
постепенном увеличении содержания дейтерия в среде, так как чувствительность к
дейтерию разных жизненно-важных систем различна.
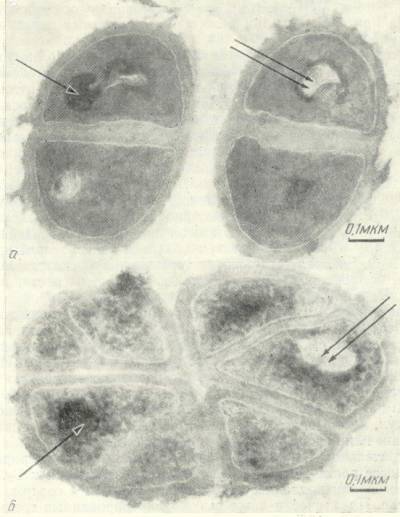
Рис. 1.
Электронные микрофотографии клеток бактерии Micrococcus lysodeikticus: (а) – протонированные клетки; (б) – дейтерированные клетки, полученные с D2О-среды [8].
Полученные
данные, в целом подтверждают устойчивое представление о том, что адаптация к D2O является фенотипическим
явлением, поскольку адаптированные к D2О клетки возвращаются после их
переноса на обычную водную среду к нормальному росту после некоторого лаг-периода. В то же время эффект обратимости роста на
Н2О/D2О-средах теоретически не исключает возможности
того, что определенный
генотип детерминирует проявление одного и того же фенотипического признака в средах различного
изотопного состава. При помещении клетки в
тяжеловодородную среду из неё не только удаляется протонированная вода за счет
реакции обмена Н2О–D2О, но и происходит быстрый H–D обмен в гидроксильных (-ОН),
сульфгидрильных (-SH) и аминогруппах (-NH2) всех органических соединений, включая белки, нуклеиновые
кислоты, углеводы, жирные кислоты. Известно, что в этих условиях только ковалентная С–Н связь не
подвергается изотопному обмену и вследствие этого только соединения со связями
типа С–D могут синтезироваться de novo. В зависимости от того, какое положение
занимает атом дейтерия в молекуле, различают первичные и вторичные изотопные
эффекты дейтерия, опосредованные межмолекулярными взаимодействиями. В этом
аспекте наиболее важными для структуры макромолекулы являются динамические
короткоживущие водородные (дейтериевые) связи. Они формируются между соседними
атомами дейтерия (водорода) и гетероатомами О, С, N, S и D2O из
окружающей среды и играют существенную роль в поддержании пространственной
структуры макромолекул и в межмолекулярных взаимодействиях. Замещение атомов
водорода дейтерием изменяет конформацию и стабильность водородных (дейтериевых)
связей в макромолекулах протеинов и ДНК, способствующих поддержанию их
структуры и стабильности. Связи, сформированные атомами дейтерия различаются по
прочности и энергии от аналогичных водородных связей. Различия в нуклеарной
массе атома H и D могут служить причиной различий в синтезах нуклеиновых
кислот, которые могут приводить к структурным различиям и к функциональным изменениям
в клетке.
Другое
важное свойство определяется пространственной структурой D2O,
имеющей тенденцию сближать гидрофобные группы макромолекул, чтобы
минимизировать их эффект на водородную (дейтериевую) связь в присутствии D2O.
Поэтому структура макромолекул белков и нуклеиновых кислот в присутствии D2O
стабилизируется, что свидетельствует о том, что кетка реализует особые
адаптивные механизмы, способствующие функциональной реорганизации работы
жизненно-важных систем в D2O. Так, например, нормальному синтезу и
функционированию в D2O нуклеиновых кислот и белков способствует
поддержание их структуры посредством формирования водородных (дейтериевых)
связей в молекулах. Большая прочность связи D…O, по сравнению с Н…О,
обуславливает различия в кинетике реакций в D2О
и Н2О.
Согласно теории абсолютных скоростей разрыв
СH-связей может происходить быстрее, чем СD-связей, подвижность иона D3О+
меньше, чем подвижность Н3О+, константа ионизации D2O
меньше константы ионизации Н2O. Самые большие изотопные эффекты в
разнице констант скоростей химических реакций с соотношением kh/kd
= 6–8 наблюдаются в D2O для C–H/C–D, N–H/N–D и O–H/O–D связей.
Эти эффекты отражаются на
кинетике химической связи и скорости химических реакций в D2O.
Протеолитические реакции в D2О значительно замедлены. Ферменты после
замещения дейтерием не прекращают своей функции, но изменения в результате
изотопного замещения за счет первичного и вторичного изотопных эффектов, а
также действие D2O как растворителя (большая структурированность и
вязкость по сравнению с Н2O) приводят к изменению скоростей
(замедлению) и специфичности ферментативных реакций в D2O [9]. Однако существуют реакции, скорость которых в D2O
выше, чем в Н2O. В основном это реакции, катализируемые ионами D3О+ или H3О+ или OD- и ОН-.
Различия
в атомной массе атома водорода и дейтерия также могут привести к изменениям
структурно-функциональных свойств жизненно-важных соединений и клеточных
органелл. Так,
структурно-динамические свойства клеточной мембраны, которые в большинстве
зависят от качественного и количественного состава липидов, также могут
изменяться в присутствии D2O. В
клетках бактерий мембрана является одним из важнейших инструментов регуляции метаболизма, объединяющая в себе аппараты биосинтеза полисахаридов,
трансформации энергии, снабжении
клетки питательными веществами и участвующая в биосинтезе белков, нуклеиновых и жирных кислот. Очевидно, при адаптации к D2O мембраны играют важную роль. Однако окончательно не выяснено, что происходит с мембранами, как они реагируют на
замену Н+ на D+ и
какое это имеет значение для выживания клеток в D2О-среде, лишенной протонов. Так, сравнительный анализ
состава жирных кислот дейтерированных клеток хемогетеротрофной
грамположительной бактерии Bacillus subtilis, полученных при росте в D2О-среде, показал различия в качественном и количественном составе
мембранных жирных кислот по сравнению с контролем на обычной воде (рис. 2 а, б). Примечательно, что в образце,
полученном с дейтерированной среды, соединения, имеющие времена удерживания –
33,38; 33,74 и 33,2 мин не детектируются (рис. 2 б). Полученный результат, по видимому,
объясняется тем, что клеточная мембрана является одной из первых органелл
клетки, которая испытывает воздействие D2О, и тем самым компенсирует
реалогические параметры мембраны (вязкость, текучесть, структурированность)
изменением не только количественного, но и качественного состава жирных кислот.
Аналогичные данные наблюдались и по соотношениям других биосинтезируемых
природных соединений при росте в D2О (аминокислоты, углеводы).
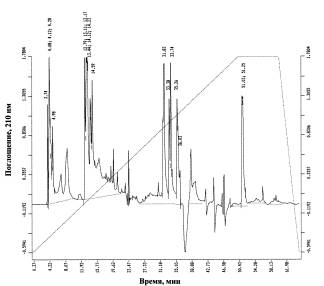
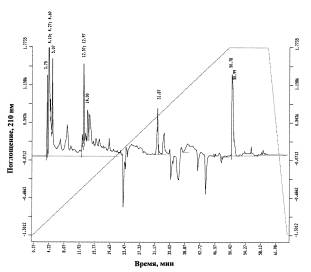
а
б
Рис. 2. Профили
жирных кислот протонированных (а) и дейтерированных (б) клеток Bacillus subtilis, выделенных с тяжеловодородной среды; хроматограф: Beckman Gold System (США), детектор: Model 126 (США); неподвижная фаза: Ultrasphere ODS 5 мкм; 4,6 x
250 мм; подвижная фаза: линейный градиент 5 мМ KH2PO4–ацетонитрил (показан пунктиром);
скорость элюирования: 0,5 мл/мин; детекция при λ = 210 нм. Пики с временами удерживания 3,75 мин (вместо
3,74 мин в контроле); 4,10; 4,27; 4,60 мин (вместо 4,08; 4,12; 4,28 мин в
контроле); 5,07 мин (вместо 4,98 мин в контроле); 12,57; 12,97 мин (вместо
12,79; 13,11; 13,17 мин в контроле); 14,00 мин (вместо 14,59 мин в контроле);
31,87 мин (вместо 31,83 мин в контроле); 33,38; 33,74; 33,26; 36,03; 50,78; 50,99 мин (вмеcто 51,03; 51,25 мин в контроле) соответствуют
индивидуальным жирным кислотам.
Полученные
экспериментальные данные свидетельствуют о том, что клетка реализует
специальные адаптивные механизмы, способствующие функциональной реорганизации
работы жизненно-важных систем и макромолекул в D2О. Наиболее
чувствительными к замене Н+ на D+ является аппарат
биосинтеза макромолекул и дыхательная цепь, т. е. те клеточные системы, использующие
высокие скорости образования и разрыва водородных связей. Данный факт позволяет
рассматривать биологическое воздействие D2О как комплексное
воздействие, действующему одновременно на функциональное состояние большого
числа систем: метаболизм, биосинтетические процессы, транспорт веществ,
структуру и функции макромолекул, морфологию и цитологию клетки.
Литература:
1.
Мосин О.В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и
микроводорослей при росте на тяжелой воде (D2O) // Вода: химия и экология. 2012. № 3. C. 83–94.
2.
Лобышев В.Н., Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. М.:
Наука, 1978. – 215 с.
3.
Денько Е.И. Действие тяжёлой воды (D2O) на клетки животных, растений и микроорганизмы. // Усп.
совр. биол. 1970. Т. 70. № 4,
С. 41–50.
4. Thomson
J.F. Physiological effects of D2O in mammals. Deuterium
Isotope Effects in Chemistry and Biology // Annals of the New York Academy of
Sciences. 1960. V. 84. P. 736–744.
5. Bild
W, Năstasă V, Haulică I. In vivo and in vitro research on the
biological effects of deuterium-depleted water: Influence of deuterium-depleted
water on cultured cell growth // Rom J. Physiol. 2004. V.41. № 1–2. P. 53–67.
6.
Мосин О.В., Складнев Д.А., Швец В.И. Изучение адаптации к тяжёлой воде // Биотехнология.
2000. № 10. С. 16–23.
7. Мосин
О.В. Изучение биотехнологических методов получения белков, аминокислот и
нуклеозидов, меченных стабильными изотопами 2H и 13С с
высокими степенями изотопного обогащения. Автореф. дисс. канд. хим. наук.
Москва, МГАТХТ им. М.В. Ломоносова, 1996. С. 1–26.
8. Еремин
В.А., Чекулаева Л.Н., Харатьян Е.Ф., Островский Д.Н. Выращивание бактерий
Micrococcus Lysodeikticus на дейтерированной среде // Микробиология. 1978. Т.
37. Вып. 4. С. 629-636.
9.
Cleland W.N, O'Leary M.H, Northrop D.D, eds. Isotope Effects on Enzyme-Catalyzed Reactions. –
Baltimore, London, Tokyo: University Park Press, 1976. – 303 p.